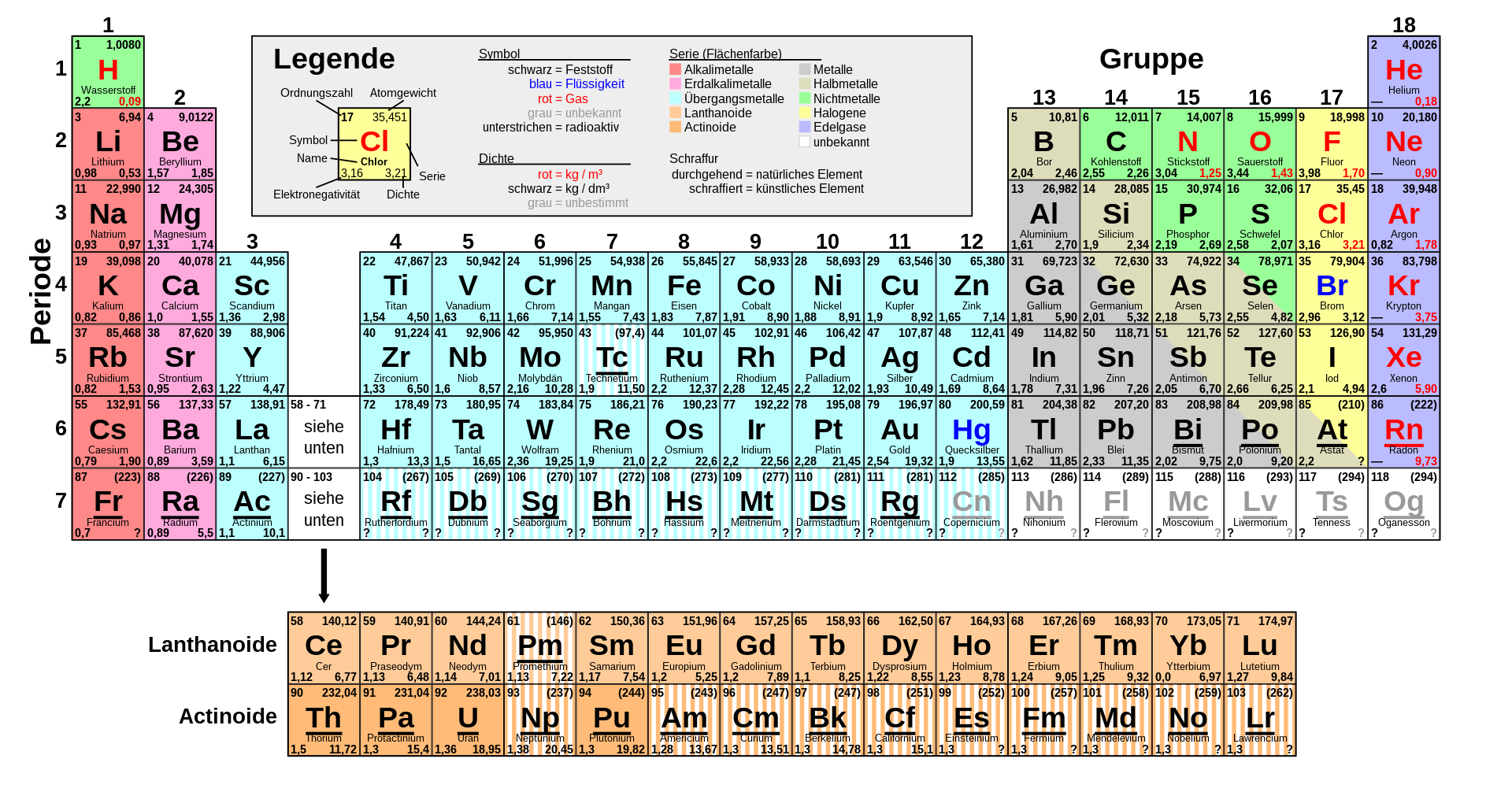
| Kontext: Für die Berechnung von Düngerlösungen benötigen Sie oft das Periodensystem, da in der Regel die Mengenangaben einer vorhandenen Düngerlösung in Bezug zu der zugesetzten Menge weiterer Düngemittel berechnet werden muß. Siehe hierzu die Artikelreihe Dünger. |
Von Antonsusi, Gemeinfrei, https://commons.wikimedia.org/w/index.php?curid=82871392
Kontext:
Krummes Atomgewicht ?Eventuell ist Ihnen aufgefallen das in älteren Periodensystemen das Atomgewicht (die kleine Zahl oben Rechts) keine Nachkommastellen hatte. Da diese die Anzahl der Protonen angibt, kann es ja gar keine Nachkommastellen geben. Dazu auch hier mehr im praktischen Zusammenhang. Im Folgenden noch etwas zur Geschichte des Periodensystems...
Die erste Tabelle mit relativen Atommassen wurde 1805 von John Dalton veröffentlicht. Er erhielt sie anhand der Massenverhältnisse bei chemischen Reaktionen, wobei er das leichteste Atom, das Wasserstoffatom, als „Masseneinheit“ wählte (siehe Atomare Masseneinheit) – dies jedoch in Unkenntnis der Eigenschaft des Wasserstoffes als zweiatomiges Molekül. Weitere relative Atom- und Molekülmassen wurden für gasförmige Elemente und Verbindungen auf der Grundlage des Avogadroschen Gesetzes berechnet, das heißt durch Abwiegen und Vergleichen bekannter Gasvolumina, später auch mit Hilfe der Faradayschen Gesetze. Avogadro bezeichnete die kleinsten denkbaren Teile noch als Moleküle. Berzelius führte dann den Begriff Atom (von altgriechisch ἄτομος átomos „unteilbar“) für den kleinsten denkbaren Teil eines Stoffes ein. Willkürlich setzte er das Atomgewicht von Sauerstoff gleich 100. Spätere Forscher wählten den leichtesten Stoff, Wasserstoff, als Standard, setzten jedoch das Wasserstoffmolekül gleich 1. Für Kohlenstoff erhielten sie dann das „Äquivalentgewicht“ 6, für Sauerstoff 8. Eigentlicher Wegbereiter für korrekte Atomgewichte von Elementen war Jean Baptiste Dumas. Er bestimmte für 30 Elemente sehr exakt die Atomgewichte und fand, dass 22 Elemente Atomgewichte hatten, die Vielfache des Atomgewichts von Wasserstoff sind. Erst Stanislao Cannizzaro führte im Jahr 1858 die heutige Unterscheidung zwischen Atom und Molekül ein. Er nahm an, dass ein Molekül Wasserstoff aus zwei Atomen Wasserstoff bestehe. Für das einzelne Wasserstoffatom setzte er willkürlich das Atomgewicht 1 fest, ein Wasserstoffmolekül hat folglich eine Molekülmasse von 2. 1865 wurde Sauerstoff, dessen Atome im Mittel annähernd die 16-fache Masse des Wasserstoffatoms haben, von Jean Servais Stas als Bezugselement vorgeschlagen und ihm die Masse 16,00 zugeteilt. 1929 entdeckten W. F. Giauque und H. L. Johnston, dass Sauerstoff drei Isotope besitzt. Das bewog die IUPAP, eine Massenskala einzuführen, die auf m(16O) basiert, während die IUPAC fortfuhr, die Ar(O) = 16, also Sauerstoff in seiner natürlichen Isotopenzusammensetzung, zu verwenden. 1957 schlugen A. O. Nier und A. Ölander unabhängig voneinander vor, dass Ar(12C) und mA(12C) = 12 u die alten atomaren Masseneinheiten ersetzen sollten. Darauf einigten sich IUPAP und IUPAC dann in den Jahren 1959–1961. Bis zu dieser Zeit hatten folglich die Physiker und die Chemiker zwei leicht unterschiedliche Massenskalen. Im Jahr 1960 publizierten F. Everling, L. A. König, Josef Mattauch und Aaldert Wapstra Massen von Nukliden. Mit dem Fortschritt der Messtechnik konnte die Avogadro-Konstante immer präziser bestimmt werden, so dass für die Definition des Mols als Einheit der Stoffmenge schließlich der „Umweg“ über eine Masse nicht mehr erforderlich war. Die 26. Generalkonferenz für Maß und Gewicht beschloss mit Wirkung zum 20. Mai 2019 die heute gültige Definition.[7] Die Teilchenzahl in einem Mol ist nun exakt festgelegt, dafür ist die Masse von 1 mol 12C jetzt eine messtechnisch bestimmbare Größe. Der nunmehr exakte Wert von NA wurde so gewählt, dass möglichst genau alle Atommassen mit ihren bisher über 12C bestimmten Werten übereinstimmen. Die folgende Tabelle zeigt einige durchschnittliche relative Atommassen je nach den vier verschiedenen Bezugsmassen. Diese sind alle durch die Neudefinition entfallen.
Quelle: https://de.wikipedia.org/wiki/Atommasse
|
||||||||||||||||||||||||||||||||||