Nährstofflösungen
 Die Steiner-Universalnährlösung ist eine der bekanntesten hydroponischen Formulierungen und wurde von Dr. Arthur Steiner entwickelt. Sie zeichnet sich durch ein ausgewogenes Verhältnis von Makro- und Mikronährstoffen aus und ist besonders für universelle Anwendungen (z. B. Gemüse, Kräuter, fruchttragende Pflanzen) geeignet. Hier ist die typische Zusammensetzung:
Die Steiner-Universalnährlösung ist eine der bekanntesten hydroponischen Formulierungen und wurde von Dr. Arthur Steiner entwickelt. Sie zeichnet sich durch ein ausgewogenes Verhältnis von Makro- und Mikronährstoffen aus und ist besonders für universelle Anwendungen (z. B. Gemüse, Kräuter, fruchttragende Pflanzen) geeignet. Hier ist die typische Zusammensetzung:
Steiner-Universalnährlösung (Standardrezeptur)
(Angaben in Gramm pro 1000 Liter Wasser, umgerechnet auf Gramm pro Liter)
| Nährsalz | Menge (g/L) | Gelieferte Nährstoffe |
|---|---|---|
| Kaliumnitrat (KNO₃) | 0,6–0,8 g/L | K (Kalium), N (Nitrat-Stickstoff) |
| Calciumnitrat (Ca(NO₃)₂) | 0,6–0,8 g/L | Ca (Calcium), N (Nitrat-Stickstoff) |
| Magnesiumsulfat (MgSO₄) | 0,4–0,5 g/L | Mg (Magnesium), S (Schwefel) |
| Monokaliumphosphat (KH₂PO₄) | 0,2–0,3 g/L | K (Kalium), P (Phosphor) |
| Eisenchelat (Fe-EDTA) | 0,02–0,03 g/L | Fe (Eisen) |
| Spurenelemente-Mix | 0,01–0,02 g/L | Mn, Zn, Cu, B, Mo (als Sulfate/Borate) |
Makronährstoff-Verhältnis (NPK):
- Stickstoff (N): ~100–150 mg/L (aus KNO₃ und Ca(NO₃)₂)
- Phosphor (P): ~30–50 mg/L (aus KH₂PO₄)
- Kalium (K): ~200–250 mg/L (aus KNO₃ und KH₂PO₄)
- Calcium (Ca): ~80–100 mg/L
- Magnesium (Mg): ~40–50 mg/L
Mikronährstoffe
- Eisen (Fe): 2–3 mg/L (als chelatisiertes Fe-EDTA für bessere Verfügbarkeit)
- Mangan (Mn): 0,5–1 mg/L
- Zink (Zn): 0,05–0,1 mg/L
- Kupfer (Cu): 0,02–0,05 mg/L
- Bor (B): 0,1–0,3 mg/L
- Molybdän (Mo): 0,01–0,02 mg/L
Eigenschaften der Lösung
- pH-Wert: Idealerweise zwischen 5,5–6,5 (ggf. mit HNO₃ oder KOH anpassen).
- Leitfähigkeit (EC): ~1,5–2,5 mS/cm, abhängig vom Pflanzenstadium.
- Vorteile:
- Stabilisiert die Nährstoffaufnahme durch hohe Kalium- und Calciumanteile.
- Geeignet für NFT-Systeme, Deep Water Culture (DWC) und Dutch Buckets.
Anpassungstipps
- Für Fruchtpflanzen (Tomaten, Gurken): Erhöhung von Kalium (K) auf 300–350 mg/L.
- Für Blattgemüse (Salate, Spinat): Reduzierung von Kalium und Erhöhung von Stickstoff.
- Bei Eisenmangel: Fe-EDTA auf 0,05 g/L erhöhen.
Hinweis zur Praxis
Die Steiner-Lösung wird oft kommerziell vorgefertigt angeboten (z. B. von Herstellern wie Hydroponic Systems), aber viele Grower mischen sie auch selbst aus Einzelsalzen. Achte auf hohe Reinheit der Salze (≥99%, technische Grade) und löse sie stets in der richtigen Reihenfolge (zuerst Calcium- und Magnesiumsalze, dann Phosphate, zuletzt Eisen und Spurenelemente).
Quelle: https://de.wikipedia.org/wiki/Hydrokulturd%C3%BCnger#N%C3%A4hrl%C3%B6sung_nach_Abram_Steiner
Bild: https://www.pexels.com/de-de/@sasha-kim/
ID: 698
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:

 Agar ist ein natürliches Geliermittel, das aus den Zellwänden bestimmter Rotalgen (z. B. Gelidium oder Gracilaria) gewonnen wird. In der Pflanzen-Zell-Züchtung dient Agar als Trägermedium für Nährstoffe und Hormone, die das Wachstum und die Differenzierung pflanzlicher Zellen in vitro fördern.
Agar ist ein natürliches Geliermittel, das aus den Zellwänden bestimmter Rotalgen (z. B. Gelidium oder Gracilaria) gewonnen wird. In der Pflanzen-Zell-Züchtung dient Agar als Trägermedium für Nährstoffe und Hormone, die das Wachstum und die Differenzierung pflanzlicher Zellen in vitro fördern.
Eigenschaften und Funktionen
- Gelbildner: Agar erstarrt bei ca. 40 °C und schmilzt erst bei etwa 85–90 °C. Dadurch eignet es sich ideal zur Stabilisierung von Nährmedien.
- Nährstoffträger: Dient als Matrix, um Wasser, Makro- und Mikronährstoffe, Zucker sowie Pflanzenwachstumsregulatoren (z. B. Auxine, Cytokinine) gleichmäßig verfügbar zu machen.
- Inert: Agar reagiert chemisch nicht mit Mediumkomponenten und ist für Pflanzenzellen weitgehend inert.
Anwendungen
- Mikropropagation (z. B. Klonen von Pflanzen über Meristeme)
- Kallus-Induktion (Wundgewebe zur Regeneration)
- Somatische Embryogenese (Entwicklung ganzer Pflanzen aus Einzelzellen)
- Gentransformationen (z. B. Agrobacterium tumefaciens-vermittelte Transformationen)
Standard-Nährmedium mit Agar (Murashige & Skoog + Agar)
Geeignet für die meisten krautigen Pflanzen in der in-vitro-Kultur.
Zutaten (für 1 Liter Medium)
|
Komponente |
Menge |
|---|---|
|
Murashige & Skoog (MS) Basalsalz |
4,43 g |
|
Saccharose (Zucker) |
30 g |
|
Agar (plant tissue culture grade) |
7–8 g |
|
pH-Wert einstellen auf |
5,7 – 5,8 |
|
Optional: Pflanzenhormone |
je nach Zweck |
|
– Benzylaminopurin (BAP, Cytokinin) |
0,5–2,0 mg/L |
|
– Indol-3-essigsäure (IAA) oder NAA |
0,1–1,0 mg/L |
Zubereitung
- Wasser (ca. 800 ml) in einen Becherglas geben.
- MS-Basalsalze und Saccharose darin vollständig lösen.
- Falls notwendig: Pflanzenwachstumsregulatoren (Hormone) hinzugeben.
- Falls hitzeempfindlich: erst nach Autoklavieren aseptisch zugeben.
- pH-Wert mit NaOH oder HCl auf 5,7–5,8 einstellen.
- Agar einrühren (am besten mit Magnetrührer). 6 - 8 g/L, siehe Tabelle unten
- Volumen mit destilliertem Wasser auf 1 Liter auffüllen.
- Medium in geeignete Gefäße abfüllen (z. B. Kulturgefäße oder Erlenmeyerkolben).
- Autoklavieren bei 121 °C und 1 atm Überdruck für 15–20 Minuten.
Empfohlene Dosierung
|
Agar-Konzentration |
Konsistenz des Mediums |
Anwendung |
|
6 g/L |
weich bis mittelfest |
empfindliche Kulturen, z. B. Wurzelung |
|
7 – 8 g/L |
normal fest |
Standard für Mikropropagation, Kallusbildung |
|
> 8 g/L |
sehr fest |
z. B. für stark wasserabsorbierende oder schwere Explantate |
Hinweis
- Nicht zu fest: Zu hohe Agar-Konzentrationen können Wasser- und Nährstoffverfügbarkeit einschränken.
- Nicht zu weich: Zu geringe Konzentrationen führen zu instabilen Medien, was die Lagerung und Kultivierung erschwert.
Quellen u.a.
- Murashige, T., & Skoog, F. (1962). A revised medium for rapid growth and bio assays with tobacco tissue cultures. Physiologia Plantarum, 15(3), 473–497.
DOI: 10.1111/j.1399-3054.1962.tb08052.x - George, E. F., Hall, M. A., & De Klerk, G.-J. (2008). Plant Propagation by Tissue Culture (Vol. 1, Springer), S. 115–122.
Literaturhinweis
- George, E. F., Hall, M. A., & De Klerk, G.-J. (2008). Plant Propagation by Tissue Culture (Vol. 1 & 2). Springer.„Agar is the most widely used gelling agent for plant tissue culture. Its inertness, high gel strength and transparency make it a standard medium component in most protocols.“ (Vol. 1, S. 115)
- Thorpe, T. A. (2007). History of plant tissue culture. Molecular Biotechnology, 37(2), 169–180.
DOI: 10.1007/s12033-007-0031-3 - Bild: Eukalyptussamen auf Agar in einer Petrischale.. https://www.flickr.com/photos/botanic-gardens-sydney/4167463471, CC BY-NC-ND 2.0
Kontext:
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen

Vorab: Sollten Sie eine Dünger-Empfehlung bekommen, ohne das Sie erklärt haben welche Pflanzen Sie ganz genau züchten, können Sie solche Empfehlungen beherzt ignorieren. Es gibt nicht hunderte von Dünger-Sorten, weil es eine Antwort gibt.
Jede Pflanzenart hat einen individuellen Nährstoffbedarf der sich auch noch dahingehend unterscheidet in welcher Wachstumsphase sie sich befindet. Darüber hinaus kann ein wahlloses Düngen, Überdüngung, Unterdüngung, falsche Zusammensetzung etc. für viele Pflanzen verheerende Folgen haben, welche von Unterversorgung bis hin zu spezifischen Pflanzenkrankheiten reichen. Um die beste Nährstoffmischung für eine spezielle Pflanze zu erreichen, kommt man um eine Analyse der Pflanze selbst nicht herum. Wir empfehlen schon aus Kostengründen die Nährstoffzusammensetzung selbst anzufertigen. Hier unser Rechner dazu...
Hydroponikdünger selber mischen ?
Die im Handel erhältlichen Düngemittel bestehen aus einem Volldünger, der mit Makronährstoffen ergänzt wird. Sie werden von einigen Hydrokultur- und/oder Düngemittelfirmen angeboten und variieren je nach Hydrokulturpflanze. Ein Beispiel für ein Düngemittelprogramm ist das von Hydro-Gardens angebotene Programm für Hydrokultur-Tomaten.
Bei diesem Programm kaufen die Züchter die Hydro-Gardens Chem-Gro-Tomatenformel. Es hat eine Zusammensetzung von 4-18-38 und enthält auch Magnesium und Mikronährstoffe. Um eine Nährlösung herzustellen, wird sie mit Kalziumnitrat und Magnesiumsulfat ergänzt, je nach Sorte und/oder Wachstumsstadium der Pflanze.
Vorteile von Düngeprogrammen
Programme wie diese sind einfach zu bedienen. Es ist nur eine minimale Bestellung von Düngemitteln erforderlich (nur 3 im Beispiel von Hydro-Gardens).
Die Herstellung von Nährstofflösungen erfordert nur sehr wenige oder gar keine mathematischen Berechnungen.
Nachteile von Düngeprogrammen
Düngeprogramme ermöglichen keine einfachen Anpassungen der einzelnen Nährstoffe. Zum Beispiel, wenn die Blattanalyse zeigt, dass mehr Phosphor benötigt wird. Bei der ausschließlichen Verwendung eines Düngeprogramms kann nicht einfach nur Phosphor hinzugefügt werden.
Ein weiterer Nachteil ist, dass die Düngeprogramme den Landwirten nicht erlauben, die bereits in der Wasserquelle enthaltenen Nährstoffe zu berücksichtigen. Wenn eine Wasserquelle beispielsweise einen Kaliumgehalt von 30 ppm aufweist, gibt es keine Möglichkeit, die im Düngeprogramm zugeführte Kaliummenge anzupassen. Und zuviel Kalium kann wiederum die Aufnahme von anderen Nährstoffen blockieren.
Düngeprogramme können teurer sein als die Verwendung von
Rezepte für Nährstofflösungen / Hydroponik Dünger selber mischen
Es gibt auch Rezepte für die Herstellung von Nährstofflösungen. Die Rezepte enthalten eine bestimmte Menge jedes Nährstoffs, der der Nährlösung zugesetzt werden soll. Sie sind spezifisch für eine bestimmte Kulturpflanze und in einer Vielzahl von Quellen erhältlich, z. B. bei den Beratungsstellen der Universitäten, im Internet und in Fachzeitschriften. Ein Beispiel ist die unten abgebildete modifizierte Sonovelds-Lösung für Kräuter (Mattson und Peters, Insidegrower).
Ein Blick auf unseren Dünge-Kalkulator macht die Sache wesentlich einfacher seine eigene Nährstofflösung zu erstellen.
Modifiziertes Sonneveld-Rezept / Kräuter
| Element | Konzentration |
| Stickstoff | 150 ppm |
| Phosphor | 31 ppm |
| Kalium | 210 ppm |
| Kalzium | 90 ppm |
| Magnesium | 24 ppm |
| Eisen | 1 ppm |
| Mangan | 0,25 ppm |
| Zink | 0,13 ppm |
| Kupfer | 0,023 ppm |
| Molybdän | 0,024 ppm |
| Bor | 0,16 ppm |
Es liegt im Ermessen des Züchters, welche Düngemittel er zur Herstellung einer Nährlösung nach einem Rezept verwendet. Zu den üblicherweise verwendeten Düngemitteln gehören:
| Dünger | Dosierung, enthaltene Nährstoffe |
|---|---|
| Kalziumnitrat | 15.5 – 0 – 0, 19% Kalcium |
| Ammoniumnitrat | 34 – 0 – 0 |
| Kaliumnitrat | 13 – 0 – 44 |
| Sequestrene 330TM | 10% Eisen |
| Kaliumphosphat monobasisch | 0 – 52 – 34 |
| Magnesium-Sulfat | 9.1% Magnesium |
| Borax (Wäschequalität) | 11 % Bor |
| Natriummolybdat | 39% Molybdän |
| Zinksulfat | 35.5% Zink |
| Kupfersulfat | 25% Kupfer |
| Magnesiumsulfat | 31% Mangan |
Vorteile von Nährstofflösungsrezepten
Nährlösungsrezepte ermöglichen die Anpassung von Düngemitteln auf der Grundlage der in Wasserquellen enthaltenen Nährstoffe. Ein Beispiel: Ein Gärtner verwendet eine Wasserquelle mit 30 ppm Kalium und stellt die modifizierte Sonneveld-Lösung für Kräuter her, die 210 ppm Kalium erfordert. Er müsste dem Wasser 180 ppm Kalium (210 ppm - 30 ppm = 180 ppm) hinzufügen, um die in diesem Rezept geforderte Menge an Kalium zu erhalten.
Mit Rezepten lassen sich Nährstoffe leicht anpassen. Wenn ein Blattanalysebericht anzeigt, dass eine Pflanze Eisenmangel hat. Es ist einfach, der Nährlösung mehr Eisen zuzusetzen.
Da Rezepte eine einfache Anpassung ermöglichen, können Düngemittel effizienter eingesetzt werden als in Düngeprogrammen. Die Verwendung von Rezepten kann weniger kostspielig sein als die Verwendung von Düngeprogrammen.
Nachteile von Nährstofflösungsrezepten
Es muss berechnet werden, wie viel Dünger der Nährlösung zugesetzt werden muss. (Link zu der Durchführung von Berechnungen). Manche Menschen mögen sich durch die damit verbundenen Berechnungen eingeschüchtert fühlen. Die Berechnungen erfordern jedoch nur unkomplizierte mathematische Fähigkeiten, die auf Multiplikation und Division beruhen.
Für die Messung von Mikronährstoffen ist auch eine hochpräzise Waage erforderlich, da die benötigten Mengen sehr klein sind. Eine solche Waage ist bereits ab 30.- € auf Amazon zu finden: z.B.: KUBEI 100g/0.001g.
Hier geht es zur Berechnung von Nährstofflösungen für den Eigenbedarf
Kontext:
ID: 153
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:


Nachdem Sie nun die beiden grundlegenden Gleichungen für die Herstellung von Nährstofflösungen kennengelernt haben, wollen wir sie verwenden, um die für ein Nährstofflösungsrezept benötigten Düngermengen zu berechnen.
Wenn Sie mit den beiden Gleichungen nicht vertraut sind, lesen Sie zuerst dies: Hydroponische Systeme: Berechnung der Konzentrationen von Nährstofflösungen mit Hilfe der beiden Gleichungen.
Hier ist unser Problem: Wir wollen eine modifizierte Sonneveld-Lösung (Mattson und Peters, Insidegrower) für Kräuter in einem NFT-System verwenden. Wir verwenden zwei 5-Gallonen-Behälter und Injektoren, die auf eine Konzentration von 100:1 eingestellt sind, und nennen sie Vorratstank A und Vorratstank B. Wie viel von jedem Dünger müssen wir in jeden Vorratstank geben ?
Sie werden nun vielleicht fragen: wozu zwei Vorratstanks? Dies ist dem Umstand geschuldet, das bestimmte Chemikalien unserer Düngerlösung miteinander reagieren sobald sie in Kontakt zueinander kommen. In allen Nährstofflösungen (Düngermischungen) haben Sie Kalzium, Phosphate und Sulfate - da, unter anderem, auch diese drei Chemikalien für alle Pflanzen lebensnotwendig sind. Die beiden Letzten reagieren mit Kalzium und sind so nicht mehr in der Form vorhanden die wir in unserer Nährlösung benötigen. Sie verbinden sich mit einander und fallen als weiße Flocken (Ausfällungen) auf den Boden des Behälters. Darum muß man Phosphate und Sulfate von Kalzium getrennt aufbewahren und beim Einbringen in die Nährlösung des Systems (mittels Dosierpumpe oder Messbecher) vor einem direkten Vermischen bewahren.
Modifiziertes Sonneveld-Rezept für Kräuter
| Element | Konzentration |
| Stickstoff | 150 ppm |
| Phosphor | 31 ppm |
| Kalium | 210 ppm |
| Kalzium | 90 ppm |
| Magnesium | 24 ppm |
| Eisen | 1 ppm |
| Mangan | 0,25 ppm |
| Zink | 0,13 ppm |
| Kupfer | 0,023 ppm |
| Molybdän | 0,024 ppm |
| Bor | 0,16 ppm |
Dies sind die Düngemittel, die wir verwenden werden. Einige Dünger enthalten mehr als einen Nährstoff in der Rezeptur, während andere nur einen enthalten. Hier eine kleine Übersicht Handelsüblicher Dünger aus denen Sie ihr Rezept zusammenstellen können
| Dünger |
Enthaltene Nährstoffe
(Stickstoff-Phosphat-Kalium und andere Nährstoffe)
|
|---|---|
| Kalziumnitrat | 15.5-0-0, 19% Ca (Kalcium) |
| Ammoniumnitrat | 34-0-0 |
| Kaliumnitrat | 13-0-44 |
| Kaliumphosphat monobasisch | 0-52-34 |
| Magnesiumsulfat | 9.1% Mg (Magnesium) |
| Sequestrene 330 TM | 10% Fe (Eisen) |
| Mangansulfat | 31% Mn (Mangan) |
| Zinksulfat | 35.5% Zn (Zink) |
| Kupfersulfat | 25% Cu (Kupfer) |
| Bor | 11% B (Bor) |
| Natriummolybdän | 39% Mo (Molybden) |
Hier finden Sie eine Liste der Düngerzusammensetzungen einiger Hersteller, die Sie als Basis für Ihre Düngerrezepte verwenden können...
Als erstes fällt auf, dass wir drei Quellen für Stickstoff (Kalziumnitrat, Ammoniumnitrat und Kaliumnitrat), zwei Quellen für Kalium (Kaliumnitrat und Kaliumphosphat einbasig) und eine Quelle für Kalzium (Kalziumnitrat) und Phosphor (Kaliumphosphat einbasig) haben. Wir können mit der Berechnung des Kalziums oder Phosphors in der Rezeptur beginnen, da nur ein Dünger jeden Nährstoff liefert. Beginnen wir mit Kalzium.
Das Rezept sieht 90 ppm Kalzium vor. Wir berechnen, wie viel Kalziumnitrat wir verwenden müssen, um dies zu erreichen, indem wir die erste unserer beiden Gleichungen anwenden.
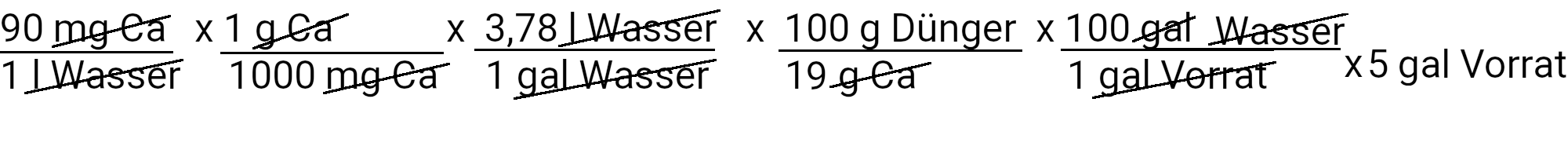
Wir müssen 895,3 g Calciumnitrat hinzufügen, um 90 ppm Calcium zu erhalten. Calciumnitrat enthält jedoch auch Stickstoff. Wir verwenden die zweite Gleichung, um zu bestimmen, wie viel Stickstoff in ppm zugeführt werden soll.
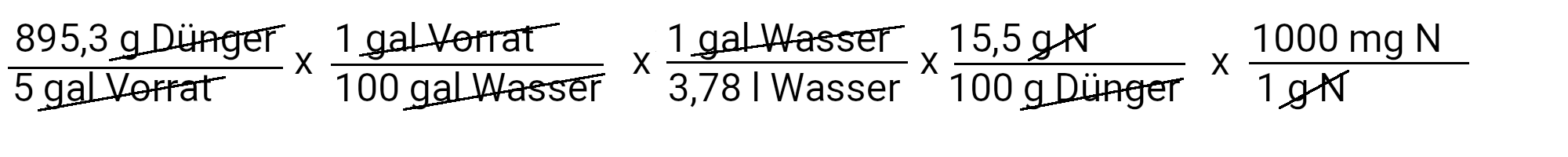
Wir fügen 73,4 mg N/l oder 73,4 ppm Stickstoff hinzu. Unser Rezept sieht 150 ppm Stickstoff vor. Wenn wir davon 73,4 ppm Stickstoff abziehen, müssen wir noch 76,6 ppm Stickstoff hinzufügen.
Berechnen wir nun, wie viel Kaliumphosphat einbasig wir verwenden müssen, um 31 ppm Phosphor zu liefern.

Wir müssen 262 g Kaliumphosphat einbasig hinzufügen, um 31 ppm Phosphor zu erhalten. Allerdings enthält Kaliumphosphat einbasig auch Kalium. Wir verwenden die zweite Gleichung, um zu bestimmen, wie viel Kalium in ppm zugeführt werden soll.
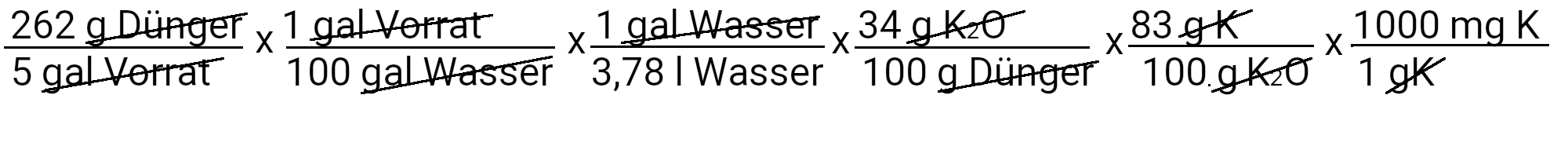
Wir fügen 39 mg K/l oder 39 ppm Kalium hinzu. Unser Rezept sieht 210 ppm Kalium vor. Wenn wir davon 39 ppm Kalium abziehen, sehen wir, dass wir noch 171 ppm Kalium hinzufügen müssen.
Wir haben nur eine weitere Quelle für Kalium, nämlich Kaliumnitrat. Berechnen wir, wie viel wir davon verwenden müssen.

Wir müssen 885 g Kaliumnitrat hinzufügen, um 171 ppm Kalium zu erhalten. Kaliumnitrat enthält jedoch auch Stickstoff. Wir verwenden die zweite Gleichung, um zu bestimmen, wie viel Stickstoff in ppm zugeführt werden soll.

Wir fügen 61 mg N/l oder 61 ppm Stickstoff hinzu. Unser Rezept sieht 150 ppm Stickstoff vor. Wir haben 73,4 ppm Stickstoff aus Kalziumnitrat zugeführt und mussten noch 76,6 ppm Stickstoff hinzufügen. Jetzt können wir 61 ppm Stickstoff subtrahieren. Wir müssen noch 15,6 ppm Stickstoff hinzufügen. Die einzige Stickstoffquelle, die uns bleibt, ist Ammoniumnitrat.
Berechnen wir nun, wie viel Ammoniumnitrat wir verwenden müssen, um 15,6 ppm Stickstoff zu liefern.

Wir müssen 86,7 g Ammoniumnitrat hinzufügen, um 15,6 ppm Stickstoff zu erhalten.
An dieser Stelle haben wir den Stickstoff-, Phosphor-, Kalium- und Kalziumteil des Rezepts abgeschlossen. Für die übrigen Nährstoffe brauchen wir nur die erste Gleichung zu verwenden, da die Düngemittel, die wir für ihre Versorgung verwenden, nur einen Nährstoff in der Rezeptur enthalten.
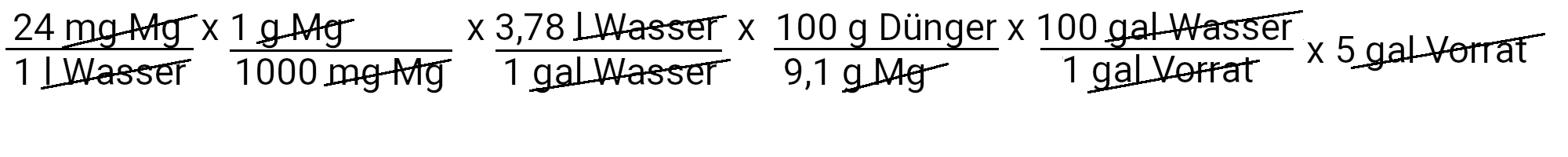
Wir müssen 498,5 Gramm Magnesiumsulfat hinzufügen, um 24 ppm Magnesium zu erhalten.
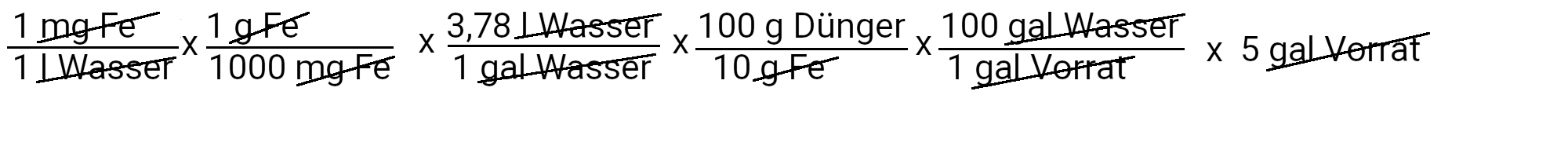 Wir müssen 18,9 Gramm Sequestren 330 hinzufügen, um 1 ppm Eisen zu erhalten.
Wir müssen 18,9 Gramm Sequestren 330 hinzufügen, um 1 ppm Eisen zu erhalten.
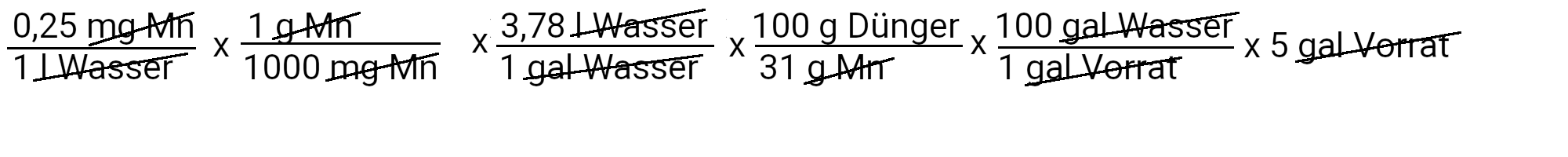
Wir müssen 1,5 Gramm Mangansulfat hinzufügen, um 0,25 ppm Mangan zu erhalten.
Es ist einfacher, kleine Mengen von Düngemitteln in Milligramm zu wiegen. Daher wird die Umrechnung von Milligramm in Gramm wie folgt vorgenommen.

Wir müssen 692 Milligramm Zinksulfat hinzufügen, um 0,13 ppm Zink zu erhalten.
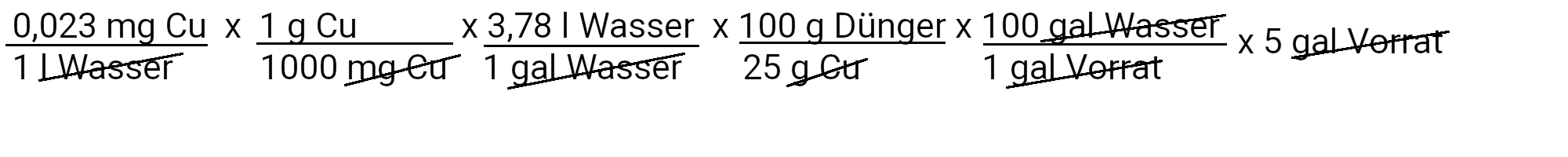
Wir müssen 0,17 Milligramm Kupfersulfat hinzufügen, um 0,023 ppm Kupfer zu erhalten.
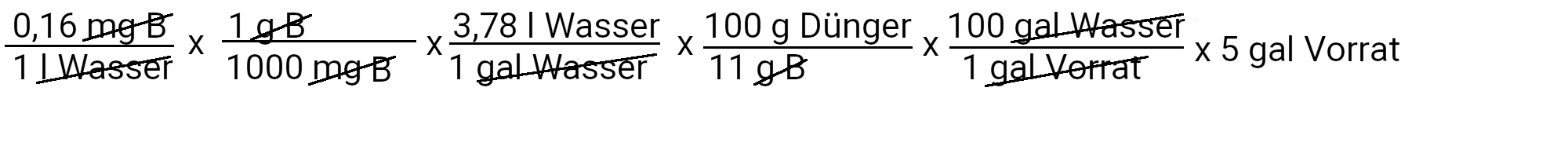
Wir müssen 2,8 Milligramm Borax hinzufügen, um 0,16 ppm Bor zu erhalten.
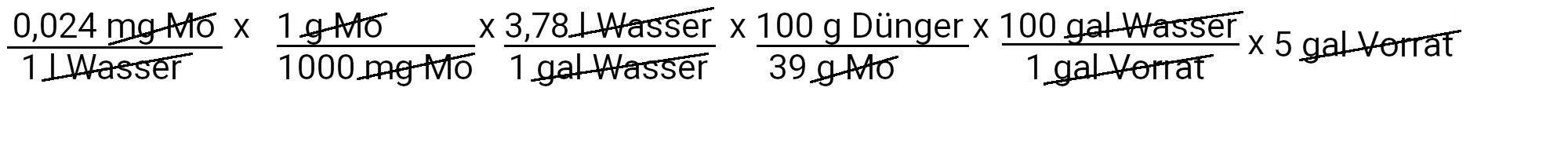
Wir müssen 0,12 Milligramm Natriummolybdat hinzufügen, um 0,024 ppm Molybdän zu erhalten.
Zusammenfassung:
| Element | Zusatz | Nährstofflösung |
| Calcium | 895,3 g Calciumnitrat | 90 ppm Calcium |
| Phosphor | 262 g Kaliumphosphat einbasig | 31 ppm Phosphor |
| Kalium | 885 g Kaliumnitrat | 171 ppm Kalium |
| Stickstoff | 86,7 g Ammoniumnitrat | 15,6 ppm Stickstoff |
| Magnesium | 498,5 Gramm Magnesiumsulfat | 24 ppm Magnesium |
| Eisen | 18,9 Gramm Sequestren 330 | 1 ppm Eisen |
| Mangan | 1,5 Gramm Mangansulfat | 0,25 ppm Mangan |
| Zink | 692 Milligramm Zinksulfat | 0,13 ppm Zink |
| Kupfer | 0,17 Milligramm Kupfersulfat | 0,023 ppm Kupfer |
| Bor | 2,8 Milligramm Borax | 0,16 ppm Bor |
| Molybdän | 0,12 Milligramm Natriummolybdat | 0,024 ppm Molybdän |
Nun sind alle Berechnungen abgeschlossen. Jetzt müssen wir entscheiden, in welchen Vorratstank, A oder B, wir die einzelnen Düngemittel geben. Im Allgemeinen sollte das Kalzium in einem anderen Tank aufbewahrt werden als die Sulfate und Phosphate, da sie Ausfällungen bilden können, die die Tropfkörper des Bewässerungssystems verstopfen können. Anhand dieser Richtlinie können wir das Kalziumnitrat in einen Tank geben und das einbasische Kaliumphosphat, Magnesiumsulfat, Mangansulfat, Zinksulfat und Kupfersulfat in den anderen Tank. Der Rest der Düngemittel kann in beide Tanks gegeben werden.
Sie sollten auch die Nährstoffmengen im Bewässerungswasser berücksichtigen. Wenn wir zum Beispiel ein Bewässerungswasser verwenden, das 10 ppm Magnesium enthält, müssen wir mit unserem Dünger nur 14 ppm mehr hinzufügen (24 ppm Mg, die in der Rezeptur gefordert werden, minus 10 ppm Mg im Wasser). Dies ist eine großartige Möglichkeit, Nährstoffe effizienter zu nutzen und Ihren Düngeplan fein abzustimmen.
Bei einigen Mikronährstoffen müssen Sie selbst entscheiden, was Sie hinzufügen möchten. Sie könnten ein kleines Experiment durchführen, um herauszufinden, ob Sie zum Beispiel 0,12 Milligramm Natriummolybdat zu Ihrer Stammlösung hinzufügen müssen oder ob Sie mit der Leistung Ihrer Pflanzen auch ohne diesen Zusatz zufrieden sind.
Ein letzter Punkt, den Sie beachten sollten. Manchmal funktionieren die Berechnungen nicht so gut wie hier bei Düngemitteln, die mehr als einen benötigten Nährstoff enthalten, und es kann sein, dass Sie mehr von einem Nährstoff hinzufügen müssen, als in der Rezeptur vorgesehen ist, um den anderen Nährstoff zu liefern.
Wenn Sie zum Beispiel Kalziumnitrat ausbringen, um den Kalziumbedarf zu decken, kann es sein, dass die Lösung nicht genug Stickstoff enthält. In solchen Fällen müssen Sie entscheiden, welchem Nährstoff Sie den Vorrang geben wollen. Sie könnten zum Beispiel Kalziumnitrat ausbringen, um den Stickstoffbedarf der Pflanzen zu decken, da die überschüssige Kalziummenge den Pflanzen nicht schadet. Oder Sie entscheiden sich dafür, es auf der Grundlage des Kalziumbedarfs der Pflanze auszubringen, weil die fehlende Stickstoffmenge nur ein paar ppm beträgt.
Hier finden Sie welche Probleme es mit Mangel und Überschuss an Dünger geben kann
Kontext:
ID: 155
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:


Die Berechnung der Düngermenge, die den Nährlösungen zugesetzt werden muss, ist Teil einer erfolgreichen hydroponischen Produktion. Für die Berechnungen werden nur Multiplikation, Division und Subtraktion verwendet; es sind keine fortgeschrittenen mathematischen Kenntnisse erforderlich.
Wenn Sie mehr über die Zusammensetzungen und Konzentrationsangaben wissen wollen kann die Artikelreihe zu Stöchiometrie und ein Blick auf die Umrechnung von Mol und Gramm bei der Konzentrationsangabe der einzelnen Elemente und Verbindungen hilfreich sein die Komplexität der Thematik besser zu verstehen.
Wenn Sie das allgemeine Verfahren beherrschen, ist die Herstellung von Nährstofflösungen und die Anpassung der Nährstoffmengen ein Kinderspiel.
Düngemittelrezepte für Hydrokulturen werden fast immer in ppm (in der Langform: Teile pro Million) angegeben. Dies kann sich von den Düngeempfehlungen für den Gemüse- und Obstanbau im Freiland unterscheiden, die im Allgemeinen in lb/acre (pounds per acre) angegeben werden.
Als erstes müssen Sie ppm in mg/l (Milligramm pro Liter) umrechnen, indem Sie diesen Umrechnungsfaktor verwenden: 1 ppm = 1 mg/l (1 Teil pro Million entspricht 1 Milligramm pro Liter). Wenn zum Beispiel in einem Rezept 150 ppm Stickstoff gefordert werden, entspricht das 150 mg/l oder 150 Milligramm Stickstoff in 1 Liter Bewässerungswasser.
In Rezepten für Nährstofflösungen werden auch ppm P (Phosphor) und ppm K (Kalium) verwendet. Dies unterscheidet sich auch von den Düngeempfehlungen für den Gemüse- und Obstanbau auf dem Feld, bei denen P2O5 (Phosphat) und K2O (Kali) verwendet werden. Die Düngemittel werden auch als Phosphat und Kali angegeben. Phosphat und Kali enthalten Sauerstoff, der bei hydroponischen Berechnungen berücksichtigt werden muss. P2O5 enthält 43% P und K2O enthält 83% K.
Lassen Sie uns die bisherigen Gegebenheiten überprüfen:
1 ppm = 1 mg/l
P2O5 = 43% P
K2O = 83% K
|
Warum sind in K2O 83% Kalium?
K₂O besteht aus 2 Kalium-Atomen und 1 Sauerstoff-Atom, also:
Molare Masse von K₂O = (2 × 39,10) + (1 × 16,00), siehe Periodensystem: Atom-Masse (meist oben rechts)
= 78,20 + 16,00 = 94,20 g/mol Die Masse der zwei Kalium-Atome in K₂O beträgt: 2 × 39,10 = 78,20 g/mol
Jetzt berechnen wir den prozentualen Anteil:
Massenanteil K = (78,20 : 94,20) x 100% = 83,00%.
Kaliumoxid (K₂O) enthält also 83 % Kalium (K) nach Masse.
|
Nährstofflösungstanks werden in den Vereinigten Staaten normalerweise in gal (Gallonen) gemessen. Wenn wir ppm in mg/l umrechnen, arbeiten wir mit Litern. Um Liter in Gallonen umzurechnen, verwenden Sie den Umrechnungsfaktor von 3,78 l = 1 gal (3,78 Liter entsprechen 1 Gallone). Weiter unten ist die Rechnung auch für kontinentale Interessenten angegeben.
Je nach der Waage, die Sie zum Wiegen von Düngemitteln verwenden, kann es nützlich sein, Milligramm in Gramm umzurechnen: 1.000 mg = 1 g (1.000 Milligramm entsprechen 1 Gramm). Wenn Ihre Waage in Pfund misst, sollten Sie diese Umrechnung verwenden: 1 lb = 454 g (1 Pfund = 454 Gramm).
Fassen wir diese Gegebenheiten zusammen:
3,78 l = 1 Gallone
1000 mg = 1 g
454 g = 1 lb
Jetzt haben wir alle notwendigen Gegebenheiten. Schauen wir uns ein Beispiel an.
Wie bestimmt man, wie viel 20-10-20-Dünger benötigt wird, um 150 ppm N mit einem 5-Gallonen-Tank und einem Düngerinjektor zu liefern, der auf eine Konzentration von 100:1 eingestellt ist?
Schreiben Sie zunächst die Konzentration auf, von der Sie wissen, dass Sie sie erreichen wollen. In diesem Fall sind es 150 ppm N oder 150 mg N/l.

Beachten Sie, dass wir mit 1 multiplizieren. So können Sie die Einheiten, die im Zähler und im Nenner gleich sind, aufheben. Jetzt können wir "mg N" streichen und erhalten die Einheit g N/l Wasser.

Setzen Sie diesen Prozess fort, indem Sie Liter in Gallonen umrechnen. Die meisten Gebinde werden immerm noch in Gallonen (3,78 Liter) gehandelt. Unterhaltsam hierbei: das Metrische System wurde von den Britten erfunden. Wollen Sie ein metrisches Ergebnis, lassen Sie diesen Rechenschritt weg.
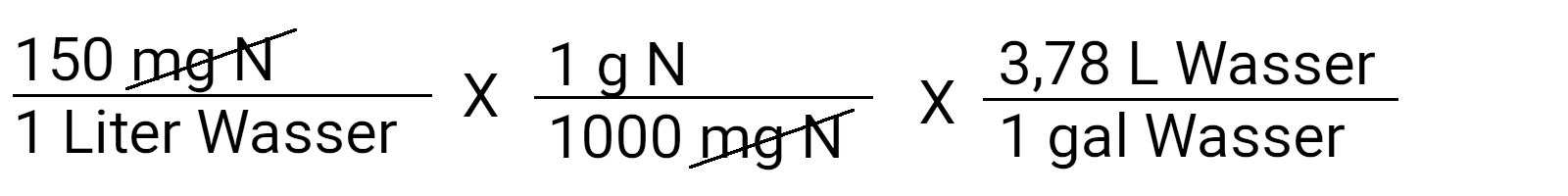
Jetzt bleiben nur noch Gramm Stickstoff pro Gallone Wasser übrig.
Wir kommen der Sache näher. Nun wollen wir Gramm Stickstoff in Gramm Dünger umrechnen. Denken Sie daran, dass unser Dünger ein 20-10-20 ist, was bedeutet, dass er 20 % Stickstoff enthält. Man kann sich das so vorstellen, dass 100 Gramm Dünger 20 Gramm Stickstoff enthalten.
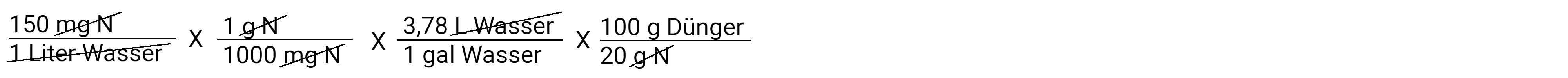
Wo stehen wir also jetzt? Wir haben berechnet, wie viel Gramm Dünger in jeder Gallone Bewässerungswasser benötigt werden. Im Moment haben wir eine normal starke Lösung. Unser Beispiel fordert uns auf, eine konzentrierte Lösung von 100:1 zu berechnen. Das bedeutet, dass für jede 100 Gallonen Wasser, die ausgebracht werden, auch 1 Gallone Stammlösung über einen Düngerinjektor ausgebracht wird. Wir wissen auch, dass unser Vorratstank 5 Gallonen fasst. Unten siehe Berechnung für metrisches System (Liter).
In Gallonen
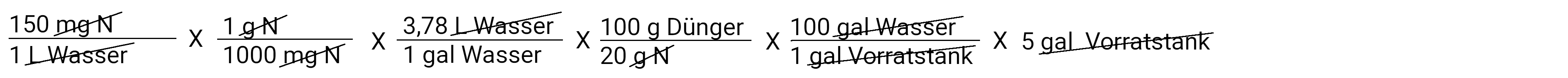
Im Taschenrechner: 150 x 1 : 1000 x 3.78 x 100 : 20 x 100 x 5 ist 1417,5 Gramm auf 5 Gallonen Wasser (im Vorratstank)
Nachdem wir alles abgezogen haben, bleibt uns ein Gramm Dünger übrig. Das ist die Menge an Dünger, die wir in unseren Vorratstank geben müssen, um 150 ppm N bei einer Konzentration von 100:1 auszubringen. Multiplizieren und teilen Sie und Sie erhalten die Antwort 1417,5 Gramm Dünger.
In Litern
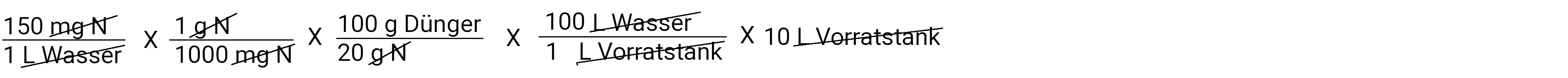
Im Taschenrechner: 150 x 1 : 1000 x 100 : 20 x 100 x 10 ist 1500 Gramm auf 10 Liter Wasser (im Vorratstank)
Nachdem wir alles abgezogen haben, bleibt uns ein Gramm Dünger übrig. Das ist die Menge an Dünger, die wir in unseren Vorratstank geben müssen, um 150 ppm N bei einer Konzentration von 100:1 auszubringen. Multiplizieren und teilen Sie und Sie erhalten die Antwort 750,0 Gramm Dünger.
Das bedeutet, dass für jede 100 Liter Wasser, die ausgebracht werden, auch 1 Liter Stammlösung über einen Düngerinjektor ausgebracht wird. Wir wissen auch, dass unser Vorratstank 10 Liter fasst.
Wenn wir in Pfund messen, müssen wir 0,75 kg / 1,15 lb Dünger in unseren Vorratstank geben, um 150 ppm N mit einer Konzentration von 100:1 auszubringen.
Sie haben gerade eine der beiden Gleichungen fertiggestellt. Schauen wir uns nun die andere an.
Wir haben gerade festgestellt, dass wir 750 Gramm Dünger hinzufügen müssen, um 150 ppm Stickstoff bei einer Konzentration von 100:1 zu liefern. Der von uns verwendete Dünger war ein 20:10:20. Zusätzlich zum Stickstoff fügen wir also auch Phosphor und Kalium hinzu. Mit der nächsten Gleichung bestimmen wir, wie viel Phosphor wir zuführen. Dies ist im Grunde die Umkehrung der ersten Berechnung.
Wir beginnen mit der Menge an Dünger, die wir in unseren Tank geben. Die endgültigen Einheiten sind ppm oder mg/l. Wie bei der vorherigen Berechnung verwenden wir unsere Vorgaben, bis wir diese Einheiten erhalten.

Multiplizieren Sie mit der Konzentration der Nährlösung.
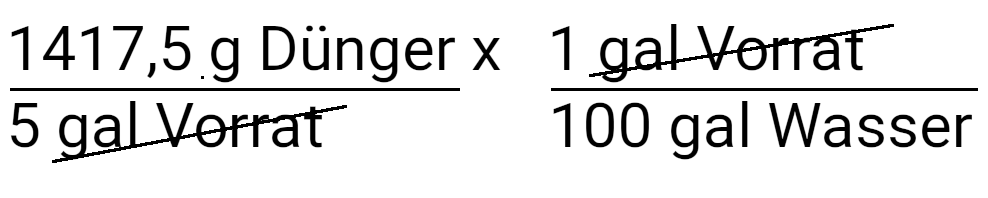
Multiplizieren, um in Liter umzurechnen.

Als Nächstes rechnen Sie Milligramm Düngemittel in Milligramm Phosphat um.

Als Nächstes werden wir Gramm Phosphat in Gramm Phosphor umrechnen, wobei wir davon ausgehen, dass Phosphat 43 % Phosphor enthält.

Zum Schluss rechnen wir Gramm Phosphor in Milligramm Phosphor um.
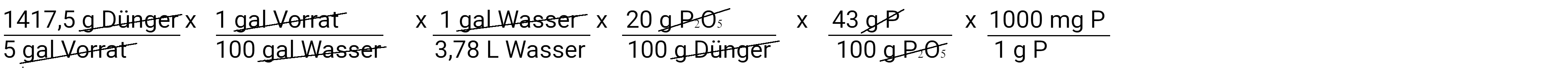
Wenn wir dies berechnen, stellen wir fest, dass wir 32,25 mg/l P oder 32,25 ppm P hinzugefügt haben. Dies ist die zweite Gleichung. Wir können sie auch verwenden, um zu bestimmen, wie viel Kalium wir hinzugefügt haben.

Wir haben 124,5 mg/l K oder 124,5 ppm K hinzugefügt.
Mit diesen beiden grundlegenden Berechnungen können Sie jedes beliebige Nährlösungsrezeptprogramm verwenden. Wie sie zur Berechnung eines Rezepts verwendet werden, können Sie in diesem Artikel sehen:
Hier finden Sie eine Beispielrezeptur und wie sie berechnet wird.
Kontext:
ID: 154
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:


Mangelerscheinungen
Bevor wir mit der Erörterung der Grundsätze der Pflanzennährstoffsysteme in hydroponischen Systemen beginnen, müssen wir definieren, was wir unter "hydroponisch" verstehen.
Unter Hydrokultur versteht man den Anbau von Pflanzen in nährstoffhaltigem Wasser. Beispiele für diese Art von Hydrokultursystemen sind NFT-Systeme (Nutrient Film Technique) und Tiefwasser-Schwimmsysteme, bei denen die Pflanzenwurzeln in Nährstofflösungen gesetzt werden. Eine andere Definition von Hydrokultur ist der Anbau von Pflanzen ohne Erde. Nach dieser Definition wird der Anbau von Pflanzen in erdelosen Medien (Blumenerde) oder anderen Arten von Aggregatmedien wie Sand, Kies und Kokosnussschalen als hydroponische Systeme betrachtet. Hier verwenden wir den Begriff Hydroponik für den Anbau von Pflanzen ohne Erde.
Wesentliche Nährstoffe
Pflanzen können ohne diese 17 essenziellen Nährstoffe nicht richtig funktionieren. Diese Nährstoffe werden benötigt, damit die für das Wachstum und die Entwicklung der Pflanzen wichtigen Prozesse ablaufen können. Magnesium ist zum Beispiel ein wichtiger Bestandteil des Chlorophylls. Chlorophyll (siehe Bild) ist ein Pigment, das dazu dient, Lichtenergie einzufangen, die für die Photosynthese benötigt wird. Es reflektiert auch grüne Wellenlängen und ist der Grund dafür, dass die meisten Pflanzen grün sind. Magnesium ist das Zentrum des Chlorophyllmoleküls. In der Tabelle unten sind die Funktionen der unabdingbaren Nährstoffe für Pflanzen aufgeführt.
Essenzielle Nährstoffe können grob in Makronährstoffe und Mikronährstoffe unterteilt werden. Die Einteilung Makro (groß) und Micro (winzig) beziehen sich auf die Mengen. Sowohl Makronährstoffe als auch Mikronährstoffe sind für das Wachstum und die Entwicklung von Pflanzen unerlässlich. Zu den Makronährstoffen gehören Kohlenstoff, Wasserstoff, Sauerstoff, Stickstoff, Phosphor, Kalium, Schwefel, Kalzium und Magnesium. Zu den Mikronährstoffen gehören Eisen, Mangan, Zink, Bor, Molybdän, Chlor, Kupfer und Nickel. Der Unterschied zwischen Makro- und Mikronährstoffen liegt in der Menge, die die Pflanzen benötigen. Makronährstoffe werden in größeren Mengen benötigt als Mikronährstoffe. Tabelle 1 zeigt den ungefähren Gehalt der Pflanzen an essenziellen Nährstoffen.
Kohlenstoff, Wasserstoff und Sauerstoff erhalten die Pflanzen aus Luft und Wasser. Die übrigen Nährstoffe stammen aus dem Boden oder im Falle der Hydrokultur aus Nährlösungen oder Aggregatmedien. Die Quellen der für die Pflanzen verfügbaren Nährstoffe sind in Tabelle 1 aufgeführt.
Essenzielle Bestandteile von Nährlösungen
| Nährstoff (Symbol) | Ungefährer Gehalt der Pflanze (% Trockengewicht) |
Rolle in der Pflanze |
Quelle des für die Pflanze verfügbaren Nährstoffs |
| Carbon (C), hydrogen (H), oxygen (O) | 90+ % | Bestandteile von organischen Verbindungen | Kohlendioxid (CO2) und Wasser (H2O) |
| Nitrogen (N) | 2–4% | Bestandteil von Aminosäuren, Proteinen, Coenzymen, Nukleinsäuren | Nitrate (NO3-) und Ammoniak (NH4+) |
| Schwefel (S) | 0.50% | Bestandteil von schwefelhaltigen Aminosäuren, Proteinen, Coenzym A | Sulfate (SO4-) |
| Phosphor (P) | 0.40% | ATP, NADPZwischenprodukte des Stoffwechsels, Membranphospholipide, Nukleinsäuren | Dihydrogenphosphat (H2PO4-), Hydrogenphosphat (HPO42-) |
| Kalium (K) | 2.00% | Enzymaktivierung, Turgor, osmotische Regulierung | Kalium (K+) |
| Kalcium (Ca) | 1.50% | Enzymaktivierung, Signaltransduktion, Zellstruktur | Calcium (Ca2+) |
| Magnesium (Mg) | 0.40% | Enzymaktivierung, Bestandteil des Chlorophylls | Magnesium (Mg2+) |
| Manganese (Mn) | 0.02% | Enzymaktivierung, wichtig für die Wasserspaltung | Mangan (Mn2+) |
| Iron (Fe) | 0.02% | Redoxveränderungen, Photosynthese, Atmung | Eisen (Fe2+) |
| Molybdenum (Mo) | 0.00% | Redox-Veränderungen, Nitratreduktion | Molybdat (MoO42-) |
| Kupfer (Cu) | 0.00% | Redoxveränderungen, Photosynthese, Atmung | Kupfer (Cu2+) |
| Zink (Zn) | 0.00% |
Kofaktor-Aktivator für Enzyme
Alkohol-Dehydrogenase, Carboanhydrase
|
Zink (Zn2+) |
| Bor (Bo) | 0.01% | Membranaktivität, Zellteilung | Borat (BO3-) |
| Chlor (Cl) | 0.1–2.0% | Ladungsausgleich, Wasserspaltung | Chlor (Cl-) |
| Nickel (Ni) | 0.000005–0.0005% | Bestandteil einiger Enzyme, biologische Stickstoff-Fixierung, Stickstoff-Stoffwechsel | Nickel (Ni2+) |
| Nährstoffbedarf kg/ha | |
| Stickstoff | 250 |
| Phosphor | 100 |
| Kalium | 400 |
| Magnesium | 80 |
| Schwefel | 20 – 30 |
| Calcium | 60 – 80 |
| Nährstoffbedarf g/ha | |
| Bor | 450 – 550 |
| Mangan | 600 – 700 |
| Eisen | 500 – 1.500 |
| Kupfer | 80 – 90 |
| Zink | 250 – 350 |
pH-Wert
Dieses Diagramm zeigt die Beziehung zwischen der Verfügbarkeit von Nährstoffen und dem pH-Wert:
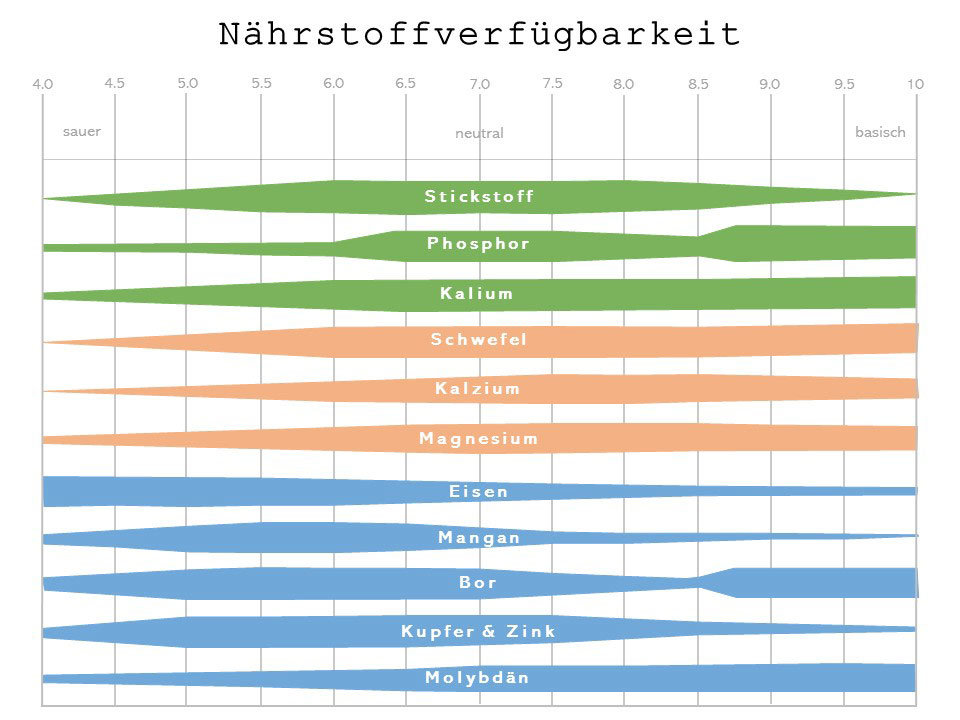
Graphik: Pensylvenia State University
Am unteren Rand des Diagramms sind verschiedene pH-Werte zwischen 4,0 und 10,0 angegeben. Am oberen Rand des Diagramms wird der relative Säuregrad oder die Alkalinität angegeben. Innerhalb des Diagramms wird die relative Nährstoffverfügbarkeit durch einen Balken dargestellt. Je breiter der Balken ist, desto besser ist der Nährstoff relativ verfügbar. Zum Beispiel ist der Stickstoffbalken bei einem pH-Wert von 6,0 bis 7,5 am breitesten. Dies ist der pH-Wert, bei dem er für die Pflanzen am besten verfügbar ist. Zwischen 4,0 und 4,5 ist er sehr schmal und nicht so leicht pflanzenverfügbar.
Es ist auch wichtig, die Alkalinität des Wassers zu berücksichtigen. Die Alkalinität ist ein Maß für die Kapazität. Sie misst die Fähigkeit des Wassers, die Säure zu neutralisieren. Dies ist in erster Linie auf die kombinierte Menge von Karbonat (CO3) und Bikarbonat (HCO3) zurückzuführen, aber auch Hydroxid, Ammonium, Borat, Silikat und Phosphat können dazu beitragen.
Wenn die Gesamtalkalität niedrig ist, hat das Wasser eine geringe Pufferkapazität. Infolgedessen ändert sich der pH-Wert leicht, je nachdem, was dem Wasser zugesetzt wird. Ist die Gesamtalkalität hoch, ist der pH-Wert des Wassers hoch. Um einen hohen pH-Wert des Wassers zu senken, kann dem Bewässerungswasser Säure zugesetzt werden. Die benötigte Menge an Säure hängt von der Alkalinität des Wassers ab.
Nährstoffantagonismus und Wechselwirkungen
Ein Beispiel: In einem Rezept für eine hydroponische Tomatennährlösung werden 190 ppm Stickstoff und 205 ppm Kalium angegeben. Aufgrund eines Fehlers bei der Berechnung der zu verwendenden Düngermenge werden 2.050 ppm Kalium hinzugefügt. Ein Überschuss an Kalium in der Lösung kann zu einem Antagonismus mit Stickstoff (und anderen Nährstoffen) führen und einen Stickstoffmangel zur Folge haben, selbst wenn 190 ppm Stickstoff hinzugefügt wurden. In der nachstehenden Tabelle sind häufige Antagonismen aufgeführt.
| Nährstoff | Antagonist von |
|---|---|
| Stickstoff | Kalium |
| Phosphor | Zink |
| Kalium | Stickstoff, Kalzium, Magnesium |
| Natrium | Kalium, Kalzium, Magnesium |
| Kalzium | Magnesium, Bor |
| Magnesium | Kalzium |
| Eisen | Mangan |
| Zink | Ionenkonkurrenz: hohe Konzentrationen an Schwermetallen, Kupfer und Phosphat vermindern die Aufnahmerate von Zink: Ursache für Zinkmangel in der Pflanze muss kein zinkarmer Boden sein |
Siehe auch: Wechselwirkungen
Probleme mit den Nährstoffen
Hydroponische Systeme verzeihen weniger als erdgebundene Systeme, und Nährstoffprobleme können schnell zu Pflanzenproblemen führen. Aus diesem Grund sind die Zusammensetzung der Nährstofflösung und die regelmäßige Überwachung der Nährstofflösung und des Nährstoffstatus der Pflanzen von entscheidender Bedeutung.
Das Minimumgesetz
Das Minimumgesetz von Carl Sprengel besagt, dass das Wachstum von Pflanzen durch die im Verhältnis knappste Ressource (Nährstoffe, Wasser, Licht etc.) eingeschränkt wird. So kommt es, dass etwa fehlender Stickstoff auch dazu führen kann, das die Pflanze andere Nährstoffe nicht verarbeiten kann. Zu viel von einer Komponente kann andererseits unerwünschte Folgen haben: So hemmt z.B. zu viel Kalk die Nährstoffaufnahme.
Hier eine kurze Übersicht der Mangelerscheinungen, die je nach Pflanzengattung variieren kann.
| Symptome | N | P | K | Ca | S | Mg | Fe | Mn | B | Mo | Zn | Cu | Überdüngung |
| Obere Blätter gelb | X | X | |||||||||||
| Mittlere Blätter gelb | X | ||||||||||||
| Untere Blätter gelb | X | X | X | X | |||||||||
| Rote Stängel | X | X | X | ||||||||||
| Nekrose | X | X | X | X | X | ||||||||
| Punkte | X | ||||||||||||
| Triebe sterben | X | ||||||||||||
| Weisse Blattspitzen | X | X | |||||||||||
| Verkrüppeltes Wachsum | X | X | X | ||||||||||
| Eingerollte gelbe Blattspitzen | X | ||||||||||||
| Verdrehtes Wachstum | X |
Ursache: Schäden durch lösliche Salze können durch Überdüngung, schlechte Wasserqualität, Anhäufung von Salzen in Aggregatmedien im Laufe der Zeit und/oder unzureichende Auswaschung verursacht werden. Düngemittel sind Salze, und in Hydrokultursystemen werden sie am häufigsten gedüngt. Wenn das Wasser verdunstet, können sich lösliche Salze in den Aggregatmedien ansammeln, wenn sie nicht ausreichend ausgewaschen werden. Auch das Bewässerungswasser kann einen hohen Gehalt an löslichen Salzen aufweisen, was zu dem Problem beiträgt.
Die Symptome: Chemisch induzierte Trockenheit kann auftreten, wenn der Gehalt an löslichen Salzen in den Pflanzsubstraten zu hoch ist. Die Folge ist, dass die Pflanzen trotz ausreichender Bewässerung welken. Weitere Symptome sind dunkelgrünes Laub, abgestorbene und verbrannte Blattränder und Wurzelsterben.
Erkennung: Der Gehalt an löslichen Salzen kann überwacht/gemessen werden, indem man die elektrische Leitfähigkeit (EC) von Bewässerungswasser, Nährlösungen und Sickerwasser (eine Nährlösung, die aus dem Pflanzgefäß abgelassen wurde) verfolgt.
Korrektur: Lösliche Salze können mit klarem Wasser ausgelaugt werden. Ermitteln Sie zunächst die Ursache für den hohen Gehalt an löslichen Salzen und beheben Sie ihn.
| Bo |
| Bo |
| Ca |
Die Ursache: Starke Temperaturänderungen können die Calciumaufnahme unterbrechen und behindern. Mangelndes Licht, kälte und/oder zu feuchte Umgebungs-Bedingungen. Düngeranteil zu niedrig. Calciummangel kann durch Unterdüngung, ein Nährstoffungleichgewicht oder einen zu niedrigen pH-Wert verursacht werden. Er hängt auch mit dem Feuchtigkeitsmanagement, hohen Temperaturen und geringer Luftzirkulation zusammen. Calzium ist ein mobiler Nährstoff und wird in den wasserführenden Geweben durch die Pflanze transportiert. Früchte und Blätter konkurrieren um Wasser. Eine niedrige relative Luftfeuchtigkeit und hohe Temperaturen können zu einer erhöhten Transpirationsrate und einem verstärkten Transport zu den Blättern führen. In diesem Fall kann sich in den Früchten ein Kalziummangel entwickeln.
Die Symptome: Die Scheitelmeristeme / Apikalmeristeme (das sind die teilungsfähigen Bildungsgewebe der Pflanze) sind deformiert und sterben ohne erkennbare Symptome an den ältesten Blättern ab. Der obere Teil des Stiels und der Blütenknospe kann sich verbiegen. Kleine und deformierte Blätter an der Oberseite. Ungewöhnlich dunkelgrüne Blätter. Vorzeitiger Blüten- und Fruchtfall. Nach einer Unterversorgung, weisen die Blätter, die sich zum Zeitpunkt des Mangels in der Entwicklung befanden, oft eine typische Verformung/Austrocknung oder einen weißen Rand auf. Dies bezeichnet man als Spitzenbrand , er tritt besonders bei Salat und Erdbeeren häufig auf. Bräunung der Innenseite eines Stiels/Kopfes, um den Wachstumspunkt herum wie bei Sellerie (schwarzes Herz). Typische Symptome sind auch Blütenendfäule an Paprika und Tomaten. Symptome zeigen sich in der Regel zunächst als braune Blattränder an neuen Pflanzen oder an der Unterseite der Früchte. Blütenendfäule bei Tomaten und Paprika. Wenn die Symptome fortschreiten, können Sie braune, tote Flecken auf den Blättern sehen. Ein Mangel an ausreichend Calcium kann zu Fäulnis führen.
Erkennung: Blattanalyse. Früchte schlechter haltbar.
Korrektur: Stellen Sie sicher, dass der pH-Wert zwischen 5,5 und 6,5 liegt. Calciumnitrat oder Calciumchlorid zufügen, je nachdem, ob Sie den zusätzlichen Stickstoff benötigen oder nicht.
Im Gewächshaus: Die Temperatur erhöhen. Mehr Licht. Ohne Wind wird der Nährstofftransport der Pflanze reduziert - im Gewächshaus für Luftbewegung sorgen.
| Fe |
| S |
Die Ursache: Zuwenig oder falsch proportionierte Düngeranteile. Ein zu niedriger pH-Wert blockiert ebenso die Aufnahme von Schwefel. Ab einem pH-Wert von 4,0 wird die Schwefelaufnahme vollständig eingestellt. Zu wenig Magnesium.
Die Symptome: Umfassende Gelbfärbung des Blattgewebes wie auch der Blattadern. Zuerst oft die jüngeren Pflanzenteile und später der ganzen Pflanze. Symptome zeigen sich eher bei jungen oder frisch wachsenden Blättern an der Spitze der Pflanze. Schwefel ist ein immobiler Nährstoff. Das heißt Schwefel kann nur relativ langsam von der Pflanze re-disponiert werden (um-transportieren). Charakteristisch für Schwefelmangel sind lindgrün bis gelbe Verfärbungen an Blättern. Sie fangen am Blattstiel an und wandern zu den Blatträndern und zur -spitze. Im weiteren Verlauf werden die ganzen Blätter erst gelb, dann später braun und nekrotisch und sterben dann gänzlich ab. Manchmal lila/rötliche Blattstiele an den betroffenen Blättern oder sogar ein lila Stamm. Die Symptome bei leichtem Mangel bleiben meist auf die Spitze der Pflanze beschränkz. Der mittlere Teil der Pflanze wird kaum betroffen, untere Blätter so gut wie nie.
Erkennung: Blattanalyse.
Korrektur: Düngerdosis erhöhen. pH-Wert korrigieren: weit über 4,0 halten. 5,5 bis 6,5 ist für viele Pflanzen ein guter Mittelwert. Erde mit Epsom-Salz / Magnesiumsulfat / MgSO4 anreichern: ein Teelöffel pro 2 Liter Wasser (ca. 1% Konzentration).
| N |
Die Ursache: Stickstoffmangel kann durch Unterdüngung, Nährstoffungleichgewicht oder übermäßige Auswaschung verursacht werden.
Allgemeine Wachstumsverzögerung.
Korrektur: Ermitteln Sie die Ursache und beheben Sie sie. Dies kann bedeuten, dass den Nährlösungen mehr Stickstoff zugesetzt wird. Es kann auch bedeuten, dass ein antagonistischer Nährstoff in der Nährlösung zu viel ist.
| K |
Erkennung: Nährstoffanalyse und / oder führen Sie eine Pflanzenanalyse durch.
| Cu |
Die jüngsten Blätter haben Schwierigkeiten, sich zu entfalten. Die jüngsten Blätter rollen sich auf und verwelken. Nekrose an den jüngsten Wachstumspunkten und den Blatträndern der jüngsten Blätter.
| Mg |
| Mn |
Bei einem Magnesiummangel sind diese grünen Streifen um die Adern herum breiter und die feinsten Blattadern vergilben ebenfalls.
| Mo |
| P |
| Zn |
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:

Dünge-Kalkulator für Hydroponik-Systeme & Erde * Version 0.25.9 * 2025-10 * Grundlagen Nährstofflösungen * Bedienungsanleitung. Mehr unter https://borgmann-aquaponik-hydroponik.ch - Download Dünge Kalkulator (³³ * 
|
|
In Düngezusätzen/Fertigdüngern suchen
|
|
Ionenbilanz Kationenladung: – mol⁺/L Anionenladung: – mol⁻/L Saldo (Netto-Ladung): – mol/L Berechneter pH-Wert (Ladungssaldo): – ¹) Geschätzter pH-Wert (Realistisch): – ¹) Geschätzte elektrische Leitfähigkeit (EC): – mS/cm |
Zusammensetzung
| Element | Quelle | Ist: g/L | Ist: mg/L = ppm | Ist: mol/Liter | Ist: mmol/L | Soll: g/L | Soll: % | Δ g/L | Name |
|---|---|---|---|---|---|---|---|---|---|
| Al | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Aluminium (Al) | |
| B | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Bor (B) | |
| Be | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Beryllium (Be) | |
| C | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Kohlenstoff (C) | |
| Ca | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Calcium (Ca) | |
| Cl | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Chlor (Cl) | |
| Co | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Kobalt (Co) | |
| Cu | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Kupfer (Cu) | |
| F | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Fluor (F) | |
| Fe | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Eisen (Fe) | |
| H | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Wasserstoff (H) | |
| K | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Kalium (K) | |
| Li | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Lithium (Li) | |
| Mg | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Magnesium (Mg) | |
| Mn | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Mangan (Mn) | |
| Mo | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Molybdän (Mo) | |
| N | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Stickstoff Summe (N) | |
| NH4 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Stickstoff (als NH₄⁺) | |
| NO3 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Stickstoff (als NO₃⁻) | |
| Na | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Natrium (Na) | |
| O | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Sauerstoff (O) | |
| P | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Phosphor (P) | |
| S | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Schwefel (S) | |
| Se | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Selen (Se) | |
| Si | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Silicium (Si) | |
| Sn | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Zinn (Sn) | |
| Ti | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Titan (Ti) | |
| Zn | 0 | 0 | 0 | 0 | 0 | 0 | 0 | Zink (Zn) |
| Im CVS Format für Excel, etc. | |
| Rezept / Zusammenstellung | Inhalts-Stoffe |
¹) Zu der pH Abschätzung: Jones, Sonneveld & Voogt, Herstellerdatenblättern (Yara, Haifa, ICL), diverse Chemische Datenbanken
¹) Zu der EC Abschätzung: Lide, CRC Handbook of Chemistry and Physics
²) Bei der Verwendung von Düngemischungen (NPK + X) ist eine Berechnung des EC- und pH-Wertes nicht möglich, da die Zusammensetzung unbekannt ist.
Die verwendeten Werte sind dann geschätzt - und somit als "Phantasie" zu betrachten. Bei Erfahrungswerten sind sie mit (real) gekennzeichnet.
³) Bei Düngeprodukten ist manchmal ein Teil des Stickstoffs als Harnstoff zugesetzt. Da dieser nicht als NO₃⁻ verwertbar ist, wird er mit dem NH₄⁺-Teil zusammengezählt. Eine weitere Differenzierung (z.B. NH₂⁻/Cyanamid) wird nicht gemacht.
⁴) Nicht alle Hersteller verraten die chemische Zusammensetzung bzw. Herkunft der jeweiligen NPK-Anteile.
⁵) Stickstoff (N) nur als NH₄⁺ oder NH₂⁻ enthalten bzw. nicht als NO₃⁻ - aber: NH₄⁺ senkt den pH-Wert im Substrat. Maximal 5–10 % des Gesamtstickstoffs für Hydroponik sollte aus NH₄⁺ stammen. Mehr ist toxisch für Hydroponik !
⁶) Dieses Pflanzenwachstumsmedium wird i.d.R. für die Kultivierung von Pflanzenzellkulturen auf Agar verwendet. Es wird auch für die Anzucht von Microgreens verwendet. Es ist hier aufgeführt da es alternative Rezepturen gibt die hier erstellt werden können. Das Original-Rezept dazu finden Sie hier: Murashige-Skoog-Medium
⁷) Fluor ist kein essentielles Pflanzennährelement. In den meisten Fällen wirkt Fluor (v. a. als Fluorid F⁻) toxisch auf Pflanzen, da es Photosynthese-Enzyme (z. B. RubisCO) hemmt, Membranen schädigt und oxidativen Stress verursacht. Pflanzen wie Tee, Aloe oder einige Farne können jedoch nennenswerte Mengen aufnehmen. Empfohlene Konzentrationen in Nährlösungen für Testzwecke liegen unter 1 mg/L, oft im Bereich von 0.1–0.5 mg/L. (vgl. Weinstein & Davison, 2004)
⁸) Quelle u.a.: J. R. Caplan et al. (2008). Nutrient Management for Medical Cannabis. Caplan et al., University of Guelph, Canada, DOI:10.17660/ActaHortic.2017.1164.9. Bugbee, B. (2020). Cannabis physiology, light response, and nutrient requirements.
ⁿ) Stickstoff (N). Herkunft unbekannt. Mögliche Quellen: z.B. NH₄⁺/Ammonium, NO₃⁻/Nitrat, NH₂⁻/Amid, CN₂H₂/Cyanamid oder Organisch/Aminosäuren. Ohne Herstellerangaben bei Fertigdüngern.
ᵖ) Phosphor (P). Herkunft unbekannt. Ohne Herstellerangaben bei Fertigdüngern.
ᵏ) Kalium (K). Herkunft unbekannt. Ohne Herstellerangaben bei Fertigdüngern.
Die zwei wichtigsten Düngertypen in Sachen Stickstoff (N):
NO₃⁻: Ist sofort pflanzenverfügbar, da Nitrat direkt von den Wurzeln aufgenommen wird: Für Hydroponik und Erde
NH₄⁺: Muss im Boden zu Nitrat nitrifiziert werden (nur durch Mikroorganismen möglich): Für Erde und Aquaponik
Die NPK-Angaben auf Düngemitteln stehen für die drei wichtigsten Pflanzennährstoffe:
* N = Stickstoff (Nitrogen)
* P = Phosphor (Phosphorus)
* K = Kalium (Potassium)
K₂O Kaliumoxid selbst wird nicht als Düngemittel (PK/NPK-Dünger) verwendet, aber dort als Maßeinheit für den Anteil von Kalium (z. B. in Form von Kaliumsulfat, Kaliumformiat, Kaliumnitrat oder Kaliumchlorid) im Düngemittel eingesetzt.
Diese Werte werden in Gewichtsprozent angegeben, und zwar in spezifischen chemischen Formen:
1. N (Stickstoff)
Chemische Form: Der Stickstoffanteil wird als elementarer Stickstoff (N) angegeben, unabhängig von der chemischen Verbindung (z. B. NH₄⁺, NO₃⁻, Harnstoff).
- Beispiel: 10 % N bedeutet, dass in 100 g Dünger 10 g reiner Stickstoff enthalten sind.
2. P (Phosphor)
Chemische Form: Angegeben wird P₂O₅ (Phosphorpentoxid) – also nicht reiner Phosphor (P).
- Beispiel: 10 % P₂O₅ bedeutet 10 g P₂O₅ pro 100 g Dünger.
3. K (Kalium)
Chemische Form: Angegeben wird K₂O (Kaliumoxid) – ebenfalls nicht reines Kalium (K).
- Beispiel: 10 % K₂O bedeutet 10 g K₂O pro 100 g Dünger.
Beispielhafte NPK-Angabe:
NPK 10-5-8 bedeutet:
- 10 % Stickstoff (N)
5 % Phosphorpentoxid (P₂O₅)
8 % Kaliumoxid (K₂O)
Das entspricht:
- 10 g N
5 g P₂O₅ ≈ 2,18 g P
8 g K₂O ≈ 6,64 g K
pro 100 g Dünger
Quellen:
Marschner, P. (2012): Marschner's Mineral Nutrition of Higher Plants, 3rd Edition, Academic Press. -> “NPK values are expressed in oxide forms for P and K (P₂O₅ and K₂O) for historical reasons and ease of comparison.”
Mengel, K., & Kirkby, E. A. (2001): Principles of Plant Nutrition, 5th Edition, Kluwer Academic Publishers.-> “The amount of nutrient applied is usually reported in oxide equivalents, not elemental form.”
Spezulative Bereiche: Titan, Zinn und Beryllium sind umstritten und/oder experimentell bzw. toxikologisch bedenklich. Hier widerspricht sich die Literatur teilweise. Sie sind der Vollständigkeit halber aufgeführt. Keine Gewähr !
Lizenz: GNU GPLv3 (CopyLeft), Autor: Helmer Borgmann
³³) P.S.: Speichern Sie diese Seite auf Ihrem Rechner zum Gebrauch ohne Internet.
Die Charts-Bibliothek "chart.js" für die Graphikdarstellung muss auch auf Ihren Rechner liegen: charts.js.
Passen Sie den Pfad in diesem Script so an, dass der Pfad auf Ihren lokalen Rechner zeigt.
Zum Beispiel in Linux: <script src="/home/hirse/chart.js"><script> oder Windows: <script src="C:\hier\bin\ich\chart.js"><script>
ID: 686
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:

 Die Hoagland-Lösung (HS) ist ein Hydrokultur Nährstoff Lösung welche von Hoagland und Snyder 1933 neu entwickelt wurde. Modifiziert von Hoagland und Arnon im Jahr 1938, und 1950 von Arnon erneut überarbeitet.
Die Hoagland-Lösung (HS) ist ein Hydrokultur Nährstoff Lösung welche von Hoagland und Snyder 1933 neu entwickelt wurde. Modifiziert von Hoagland und Arnon im Jahr 1938, und 1950 von Arnon erneut überarbeitet.
Es ist eines der beliebtesten Standardlösungszusammensetzungen für das Wachsen Pflanzenin der wissenschaftliche Welt mindestens mit mehr als 21.000 Zitaten von Google Scholar - was nicht unbedingt ein Qulitätsaspekt ist, siehe Eisengehalt von Spinat.
Die Hoagland-Lösung liefert alle wesentlichen Elemente für Pflanzenernährung und ist geeignet, um normal zu unterstützen Wachstum einer großen Vielfalt von Pflanzenarten. Die künstliche Lösung beschrieben durch Dennis Hoagland im Jahr 1933, bekannt als Hoagland-Lösung, wurde mehrmals modifiziert, hauptsächlich durch hinzuzufügen von Eisenchelate und anderen Spurenelemente.
In Hoaglands Nährstoffrezepten von 1938, die als Hoagland-Lösung (1 und 2) bezeichnet werden, wurde die Anzahl der Spurenelemente anschließend auf die allgemein anerkannten wesentliche Elemente (B., Mn, Zn, Cu, Mo., Fe, und Cl) reduziert . Spätere Untersuchungen bestätigten, dass ihre Konzentrationen an ein optimales Pflanzenwachstum angepasst worden waren.
In Arnons Revision von 1950 nur eine Konzentration (Mo 0,011 ppm) wurde im Vergleich zu 1938 (Mo 0,048 ppm) geändert, während die Konzentration von Makronährstoffe der Hoagland-Lösungen (0), (1) und (2) blieb seit 1933 gleich, mit Ausnahme von Kalzium (160 ppm) in Lösung. Der Hauptunterschied zwischen Lösung (1) und Lösung (2) ist die unterschiedliche Verwendung von Nitrat-Stickstoff und der Ammonium-Stickstoffbasis.
Zusammensetzung und Konzentrationen der Makronährstoffe
in Hoaglands Lösungen (0, 1, 2) und in Knops Lösung
| Macronutrients | Hoaglands Lösung 0 und 1 | Hoaglands Lösung 2 | Knops Lösung |
| Menge in der Lösung | |||
| μmol/L | μmol/L | μmol/L | |
| K+ | 6,000 | 6,000 | 4,310 |
| Ca2+ | 5,000* | 4,000** | 6,094 |
| Mg2+ | 2,000 | 2,000 | 1,014 |
| NO3− | 15,000 | 14,000 | 14,661 |
| NH4+ | - | 1,000 | - |
| SO42− | 2,000 | 2,000 | 1,014 |
| PO43− | 1,000 | 1,000 | 1,837 |
Anwendungen
Pflanzennährstoffe werden normalerweise von der Bodenlösung absorbiert. Die Hoagland-Lösung, ursprünglich zur Nachahmung einer (nährstoffreichen) Bodenlösung, hat hohe Konzentrationen von N und K, so dass es sehr gut für die Entwicklung großer Pflanzen wie geeignet ist wie Tomate und Paprika.
Komponenten
Salze, Säuren und komplexe Ionen werden zur Herstellung der Hoagland-Hydroponiklösungsformulierungen (1) und (2) verwendet.
- Kaliumnitrat, KNO3
Calciumnitrattetrahydrat, Ca (NO3)2• 4H2O.
Magnesiumsulfat-Heptahydrat, MgSO4• 7H2O.
Kaliumdihydrogenphosphat, KH2PO4 oder
Ammoniumdihydrogenphosphat (NH4) H.2PO4
Borsäure, H.3BO3
Manganchloridtetrahydrat, MnCl2• 4H2O.
Zinsulfat-Heptahydrat, ZnsO4• 7H2O.
Kupfersulfatpentahydrat, CuSO4• 5H2O.
Molybdsäuremonohydrat, H.2MoO4•H2O oder
Natriummolybdatdihydrat, Na2MoO4• 2H2O.
Eisentartrat oder Eisen (III) -EDTA− oder Eisenchelat (Fe-EDDHA−)
Komponenten für Hoagland-Lösung 1
Um die Stammlösungen vorzubereiten und eine vollständige Hoagland-Lösung zu erhalten hier die Bestandteile:
Tabelle 1
| Komponente | Mengen in Lösung | |
|---|---|---|
| g / l | ml / l | |
| Makronährstoffe | ||
| 2M KNO3 | 202 | 2.5 |
| 2M Ca (NO3)2• 4H2O. | 472 | 2.5 |
| 2M MgSO4• 7H2O. | 493 | 1 |
| 1M KH2PO4 | 136 | 1 |
| Mikronährstoffe | ||
| H.3BO3 | 2,86 | 1 |
| MnCl2• 4H2O. | 1,81 | 1 |
| ZnsO4• 7H2O. | 0,22 | 1 |
| CuSO4• 5H2O. | 0,08 | 1 |
| H.2MoO4•H2O, oder | 0,09 | 1 |
| Na2MoO4• 2H2O. | 0,12 | 1 |
| Eisen | ||
| C.12H.12Fe2O.18, oder Sprint 138 Eisenchelat* * |
5 15 |
1 1.5 |
Komponenten für Hoagland-Lösung 2
Um die Stammlösungen vorzubereiten und eine vollständige Hoagland-Lösung zu erhalten hier die Bestandteile:
Tabelle 2
| Komponente | Mengen in Lösung | |
|---|---|---|
| g / l | ml / l | |
| Makronährstoffe | ||
| 2M KNO3 | 202 | 3 |
| 2M Ca (NO3)2• 4H2O. | 472 | 2 |
| 2M MgSO4• 7H2O. | 493 | 1 |
| 1M NH4H.2PO4 | 115 | 1 |
| Mikronährstoffe | ||
| H.3BO3 | 2,86 | 1 |
| MnCl2• 4H2O. | 1,81 | 1 |
| ZnsO4• 7H2O. | 0,22 | 1 |
| CuSO4• 5H2O. | 0,08 | 1 |
| H.2MoO4•H2O. | 0,02 | 1 |
| Eisen | ||
|
C.12H.12Fe2O.18, oder
Sprint 138 Eisenchelat *
|
5 15 |
1 1.5 |
Spurenelementzusatz nach D. R. Hoagland
- Ein Liter fertige Hoagland-Lösung (ergänzende Nährstofflösung, Lösung A) enthält:
55 mg Al2(SO4)2
28 mg KJ
28 mg KBr
55 mg TiO2
28 mg SnCl2 · 2 H2O
28 mg LiCl
389 mg MnCl2 · 4 H2O
614 mg B(OH)3
55 mg ZnSO4
55 mg CuSO4 · 5 H2O
59 mg NiSO4 · 7 H2O
55 mg Co(NO3)2 · 6 H2O
Kontext:
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:

Ja, aber mit Einschränkungen: Ammoniumnitrat (NH₄NO₃) kann in der Hydroponik verwendet werden, muss jedoch vorsichtig dosiert werden.
- NH₄⁺ (Ammonium) – pflanzenverfügbar, aber potenziell toxisch
- NO₃⁻ (Nitrat) – gut verträglich, Hauptstickstoffquelle
- Liefert zwei Stickstoffformen
- Kann zur pH-Stabilisierung beitragen (NO₃⁻ basisch, NH₄⁺ sauer)
- Ammonium-Toxizität: Bei hoher Konzentration oder niedrigem pH schädlich
- pH-Verschiebung: NH₄⁺ senkt den pH-Wert im Substrat
- Sicherheitsaspekte: NH₄NO₃ ist reguliert (Explosivstoffverordnung, EU)
| Dünger | Funktion |
|---|---|
| Ca(NO₃)₂ | Nitrat + Kalzium |
| KNO₃ | Nitrat + Kalium |
| NH₄NO₃ | zusätzlicher NH₄⁺-Stickstoff (vorsichtig dosieren) |
| MgSO₄ | Magnesium + Schwefel |
| KH₂PO₄ | Kalium + Phosphat |
“Ammonium nitrate may be used to partially replace nitrate forms of nitrogen, but excessive ammonium can inhibit uptake of other nutrients and cause pH instability.” – Resh, H. M. (2012), Hydroponic Food Production
“Ammonium supply should not exceed 10% of total nitrogen to avoid toxicity and growth suppression.” – Sonneveld, C. & Voogt, W. (2009), Plant Nutrition of Greenhouse Crops
Fazit
Ammoniumnitrat ist unter kontrollierten Bedingungen einsetzbar. Beachten Sie: Dosis, pH-Kontrolle und Lagerung gemäß Vorschriften.
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
 Murashige- und Skoog-Medium (oder MSO oder MS0 (MS-Null) ) ist das beliebteste Pflanzenwachstumsmedium , das in Laboren weltweit für die Kultivierung von Pflanzenzellkulturen auf Agar verwendet wird. MS0 wurde 1962 von den Pflanzenwissenschaftlern Toshio Murashige und Folke K. Skoog während Murashiges Suche nach einem neuen Wachstumsregulator erfunden.
Murashige- und Skoog-Medium (oder MSO oder MS0 (MS-Null) ) ist das beliebteste Pflanzenwachstumsmedium , das in Laboren weltweit für die Kultivierung von Pflanzenzellkulturen auf Agar verwendet wird. MS0 wurde 1962 von den Pflanzenwissenschaftlern Toshio Murashige und Folke K. Skoog während Murashiges Suche nach einem neuen Wachstumsregulator erfunden.
Eine Zahl hinter den Buchstaben MS gibt den Saccharosegehalt des Mediums an. Beispielsweise enthält MS0 keine Saccharose, MS20 hingegen 20 g/l Saccharose. Zusammen mit seinen Modifikationen ist es das am häufigsten verwendete Medium für Pflanzengewebekulturexperimente im Labor.
Als Skoogs Doktorand machte sich Murashige ursprünglich auf die Suche nach einem bislang unentdeckten Wachstumshormon im Tabaksaft. Ein solcher Bestandteil wurde jedoch nicht gefunden; stattdessen ergaben Analysen von Tabaksaft und Tabakasche höhere Konzentrationen bestimmter Mineralien im Pflanzengewebe als bisher bekannt. Eine Reihe von Experimenten zeigte, dass unterschiedliche Konzentrationen dieser anorganischen Nährstoffe das Wachstum im Vergleich zu bestehenden Formulierungen deutlich steigerten. Insbesondere Stickstoff förderte das Wachstum von Tabak in Gewebekulturen.
Nach neueren wissenschaftlichen Erkenntnissen ist MS- Medium jedoch nicht als Nährlösung für die Tiefwasserkultur oder Hydrokultur geeignet, und organische Verbindungen werden für die normale Pflanzenernährung nicht benötigt.
Wichtige Salze (Makronährstoffe)
- Ammoniumnitrat (NH 4 NO 3 ) 1650 mg/l
- Calciumchlorid (CaCl 2 · 2H 2 O) 440 mg/l
- Magnesiumsulfat (MgSO 4 · 7H 2 O) 180,7 mg/l
- Monokaliumphosphat (KH 2 PO 4 ) 170 mg/l
- Kaliumnitrat (KNO 3 ) 1900 mg/l
Spurensalze (Mikronährstoffe)
- Borsäure (H 3 BO 3 ) 6,2 mg/l
- Cobaltchlorid (CoCl 2 · 6H 2 O) 0,025 mg/l
- Eisensulfat (FeSO 4 · 7H 2 O) 27,8 mg/l
- Mangan(II)sulfat (MnSO 4 · 4H 2 O) 22,3 mg/l
- Kaliumiodid (KI) 0,83 mg/l
- Natriummolybdat (Na 2 MoO 4 · 2H 2 O) 0,25 mg/l
- Zinksulfat (ZnSO 4 ·7H 2 O) 8,6 mg/l
- Ethylendiamintetraessigsäure Eisen(III)-Natrium (FeNaEDTA) 36,70 mg/L
- Kupfersulfat (CuSO 4 · 5H 2 O) 0,025 mg/l
Vitamine und organische Verbindungen
- Myo-Inositol 100 mg/l
- Nicotinsäure 0,5 mg/l
- Pyridoxin · HCl 0,5 mg/l
- Thiamin · HCl 0,1 mg/l
- Glycin 2 mg/l
- Trypton 1 g/l (optional)
- Indolessigsäure 1-30 mg/l (optional)
- Kinetin 0,04–10 mg/l (optional)
Kontext:
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:

Ein Kilo kostet etwa 30.- bis 49.- Euro und reicht für etwa 500 Liter Nährstofflösung (je nach Mischverhältnis)
|
Mischungsverhältnis 2 : 1 : 3
Inhalt der beiden Behälter a 500 ml
|
|
|
Lösung 1
120 Gramm Masterblend 4-18-38 (etwa 1/2 Tasse und ein Esslöffel)
60 Gramm Magnesiumsulfat (etwa 4 Esslöffel)
|
den Rest der Flasche mit Wasser auffüllen |
|
Lösung 2
180 Gramm Calziumnitrat (etwa 3/4 Tasse)
|
den Rest der Flasche mit Wasser auffüllen |
| Pflanzen | Konzentration | Reichweite bei 500 ml Konzentrat |
| Fruchttragende Beetpflanzen |
Für Lösung 1: 3 ml pro Liter Wasser: für 10 Liter nehmen Sie 30 ml, für 1 Gallone 12 ml
Für Lösung 2: 3 ml pro Liter Wasser: für 10 Liter nehmen Sie 30 ml, für 1 Gallone 12 ml
|
160 Liter |
| Grünes Blattgemüse | Für Lösung 1: 2,5 ml pro Liter Wasser: für 10 Liter nehmen Sie 25 ml, für 1 Gallonen 8 ml
Für Lösung 2: 2,5 ml pro Liter Wasser: für 10 Liter nehmen Sie 25 ml, für 1 Gallonen 8 ml
|
200 Liter |
* ) Umrechnung
Kontext:
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:


| Element | Rolle | Ionenform (en) | Niedriger Bereich (ppm) | Hoher Bereich (ppm) | Gemeinsame Quellen | Kommentar |
| Stickstoff | Essentieller Makronährstoff |
NO-3
oder
NH+4
|
100 | 1000 | KNO 3, NH 4 NO 3, Ca (NO 3) 2, HNO 3, (NH 4) 2 SO 4 und (NH 4) 2 HPO 4 | NH+4 stört die Ca2+-Aufnahme und kann für Pflanzen toxisch sein, wenn sie als Hauptstickstoffquelle verwendet wird.Ein 3:1-Verhältnis von NO-3 -N zu NH+4-N (Gew.-%) wird manchmal empfohlen, um den pH-Wert während der Stickstoffabsorption auszugleichen.Pflanzen reagieren je nach Form des Stickstoffs unterschiedlich, z. B. hat Ammonium eine positive Ladung, und somit stößt die Pflanze ein Proton aus (H. + ) für jeden NH + 4 aufgenommen, was zu einer Verringerung des Rhizosphären-pH führt.Bei Lieferung mit NO - 3 Das Gegenteil kann eintreten, wenn die Pflanze Bicarbonat (HCO) freisetzt - 3 ), der den pH-Wert der Rhizosphäre erhöht.Diese Änderungen des pH-Werts können die Verfügbarkeit anderer pflanzlicher essentieller Mikronährstoffe (z. B. Zn, Ca, Mg) beeinflussen. |
| Kalium | Essentieller Makronährstoff | K + | 100 | 400 | KNO 3, K 2 SO 4, KCl, KOH, K 2 CO 3, K 2 HPO 4 und K 2 SiO 3 | Hohe Konzentrationen beeinträchtigen die Funktion Fe, Mn und Zn.Zinkmängel sind häufig am offensichtlichsten. |
| Phosphor | Essentieller Makronährstoff | PO3− 4 | 30 | 100 | K 2 HPO 4, KH 2 PO 4, NH 4 H 2 PO 4, H 3 PO 4 und Ca (H 2 PO 4) 2 | Überschüssiges NR-3 neigt dazu, PO zu hemmen 3− 4 Absorption.Das Verhältnis von Eisen zu PO 3− 4 kann Co-Präzipitationsreaktionen beeinflussen. |
| Kalzium | Essentieller Makronährstoff | Ca 2+ | 200 | 500 | Ca (NO 3) 2, Ca (H 2 PO 4) 2, CaSO 4, CaCl 2 | Überschüssiges Ca 2+hemmt die Mg 2+-Aufnahme. |
| Magnesium | Essentieller Makronährstoff | Mg 2+ | 50 | 100 | MgSO 4 und MgCl 2 | Sollte die Ca 2+-Konzentration aufgrund der kompetitiven Aufnahmenicht überschreiten. |
| Schwefel | Essentieller Makronährstoff | SO 2− 4 | 50 | 1000 | MgSO 4, K 2 SO 4, CaSO 4, H 2 SO 4, (NH 4) 2 SO 4, ZnSO 4, CuSO 4, FeSO 4 und MnSO 4 | Im Gegensatz zu den meisten Nährstoffen können Pflanzen eine hohe Konzentration des SO tolerieren 2− 4 selektives Absorbieren des Nährstoffs nach Bedarf.Es tretenjedoch immer nochunerwünschte Gegenioneneffekte auf. |
| Eisen | Essentieller Mikronährstoff | Fe 3+und Fe 2+ | 2 | 5 | Fe DTPA, Fe EDTA, Eisen - Citrat, Eisen -Tartrat, FeCl 3, Eisen -III -EDTA und FeSO 4 | pH- Werte über 6,5 verringern die Eisenlöslichkeit stark. Chelatbildner (z. B. DTPA, Zitronensäure oder EDTA) werden häufig zugesetzt, um die Eisenlöslichkeit über einen größeren pH-Bereich zu erhöhen. |
| Zink | Essentieller Mikronährstoff | Zn 2+ | 0,05 | 1 | ZnSO 4 | Überschüssiges Zink ist für Pflanzen hochgiftig, aber für Pflanzen in geringen Konzentrationen essentiell. |
| Kupfer | Essentieller Mikronährstoff | Cu 2+ | 0,01 | 1 | CuSO 4 | Die Empfindlichkeit der Pflanzen gegenüber Kupfer ist sehr unterschiedlich.0,1 ppm können für einige Pflanzen toxisch sein, während eine Konzentration von bis zu 0,5 ppm für viele Pflanzen oft als ideal angesehen wird. |
| Mangan | Essentieller Mikronährstoff | Mn 2+ | 0,5 | 1 | MnSO 4 und MnCl 2 | Die Aufnahme wird durch einen hohen PO erhöht 3− 4 Konzentrationen. |
| Bor | Essentieller Mikronährstoff | B (OH)- 4 | 0,3 | 10 | H 3 BO 3 und Na 2 B 4 O 7 | Einige Pflanzen sind jedoch ein essentieller Nährstoff und reagieren sehr empfindlich auf Bor (z. B. treten bei Zitrusbäumen bei 0,5 ppmtoxische Wirkungenauf). |
| Molybdän | Essentieller Mikronährstoff | Mn- 4 | 0,001 | 0,05 | (NH 4) 6 Mo 7 O 24 und Na 2 MoO 4 | Ein Bestandteil des Enzyms Nitratreduktase, der von Rhizobien zur Stickstofffixierung benötigt wird. |
| Nickel | Essentieller Mikronährstoff | Ni 2+ | 0,057 | 1.5 | NiSO 4 und NiCO 3 | Unentbehrlich für viele Pflanzen (z. B. Hülsenfrüchte und einige Getreidepflanzen).Wird auch im Enzym Urease verwendet. |
| Chlor | Variabler Mikronährstoff | Cl - | 0 | Sehr variabel | KCl, CaCl 2, MgCl 2 und NaCl | Kann NO stören - 3 Aufnahme in einigen Pflanzen, kann aber in einigen Pflanzen von Vorteil sein (z. B. in Spargel bei 5 ppm).Fehlt in Nadelbäumen, Farnen und den meisten Bryophyten. |
| Aluminium | Variabler Mikronährstoff | Al 3+ | 0 | 10 | Al 2 (SO 4) 3 | Unentbehrlich für einige Pflanzen (z. B. Erbsen, Mais, Sonnenblumen und Getreide ).Kann für einige Pflanzen unter 10 ppm toxisch sein.Wird manchmal zur Herstellung von Blütenpigmenten verwendet (z.B. von Hortensien ). |
| Silizium | Variabler Mikronährstoff | SiO 2− 3 | 0 | 140 | K 2 SiO 3, Na 2 SiO 3 und H 2 SiO 3 | In den meisten Pflanzen vorhanden, reichlich in Getreide, Gräsern und Baumrinde.Beweis, dass SiO 2− 3 verbessert die Resistenz gegen Pflanzenkrankheiten. |
| Titan | Variabler Mikronährstoff | Ti 3+ | 0 | 5 | H 4 TiO 4 | Könnte essentiell sein, aber Spuren von Ti 3+sind so allgegenwärtig, dass seine Zugabe selten gerechtfertigt ist.Bei 5 ppm sind günstige Wachstumseffekte bei einigen Kulturen bemerkenswert (z. B. Ananas und Erbsen). |
| Kobalt | Nicht essentieller Mikronährstoff | Co 2+ | 0 | 0,1 | CoSO 4 | Erforderlich bei Rhizobien, wichtig für die Knötchenbildung von Hülsenfrüchten. |
| Natrium | Nicht essentieller Mikronährstoff | Na + | 0 | Sehr variabel | Na 2 SiO 3, Na 2 SO 4, NaCl, NaHCO 3 und NaOH | Na +kann K +in einigen Pflanzenfunktionenteilweise ersetzen,aber K +ist immer noch ein essentieller Nährstoff. |
| Vanadium | Nicht essentieller Mikronährstoff | VO 2+ | 0 | Spur, unbestimmt | VOSO 4 | Vorteilhaft für die rhizobielle N 2 -Fixierung. |
| Lithium | Nicht essentieller Mikronährstoff | Li + | 0 | Unbestimmt | Li 2 SO 4, LiCl und LiOH | Li +kann den Chlorophyllgehalt einiger Pflanzen (z. B. Kartoffel- und Pfefferpflanzen )erhöhen. |
- Details
- Hauptkategorie: Technik
- Kategorie: Nährstofflösungen
-
Auch verfügbar:




